Содержание
- 2. Коллоидные частицы по размерам занимают промежуточное положение между грубодисперсными частицами и молекулами. Они доступны для наблюдения,
- 3. Ро́берт Бро́ун (англ. Robert Brown, 1773—1858) — британский (шотландский) ботаник, 1773—1858) — британский (шотландский) ботаник конца
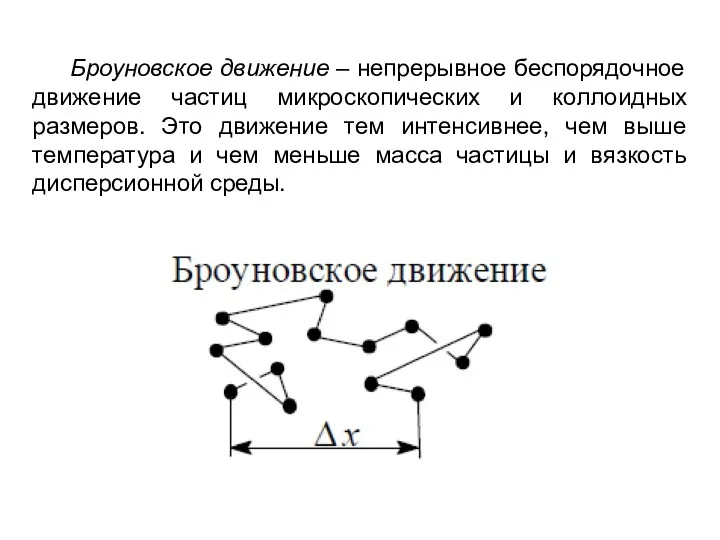
- 4. Броуновское движение – непрерывное беспорядочное движение частиц микроскопических и коллоидных размеров. Это движение тем интенсивнее, чем
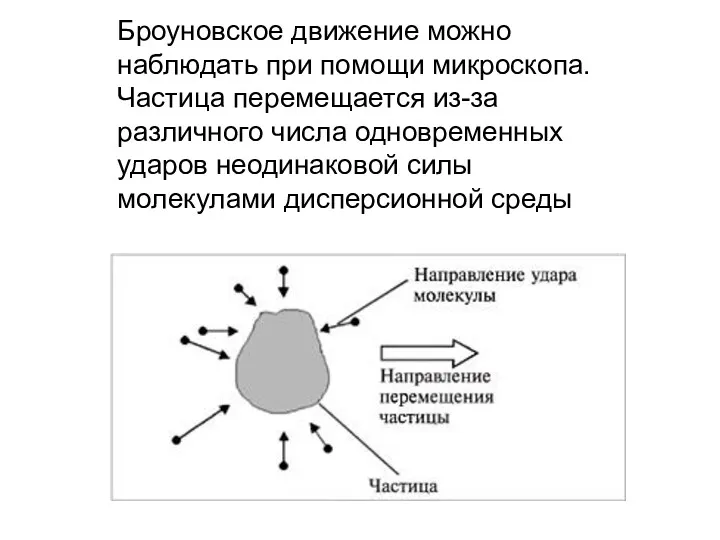
- 5. Броуновское движение можно наблюдать при помощи микроскопа. Частица перемещается из-за различного числа одновременных ударов неодинаковой силы
- 6. В результате хаотического движения частиц дисперсной фазы наблюдается диффузия (от лат diffusio – распространение) (выравнивание их
- 7. Диффузия описывается первым законом Фика коэффициент диффузии
- 9. Молекулярно-кинетические свойства коллоидов … Диффузия ‒ самопроизвольный процесс выравнивания концентрации частиц за счёт их теплового движения.
- 11. Теория броуновского движения была разработана А.Эйнштейном и М.Смолуховским. Первая работа Эйнштейна посвященная количественной теории броуновского движения
- 12. Мариан Смолуховский (1872–1917) Впервые в 1904 году дал строгое объяснение броуновского движения
- 13. Альберт Эйнштейн (1879-1955) В 1905 году создал первую количественную теорию броуновского движения. С помощью статистических методов
- 14. Альберт Эйнштейн (1879 ‒ 1955)
- 16. По уравнению Эйнштейна - Смолуховского зная размеры частицы и экспериментально определив величину среднего сдвига можно рассчитать
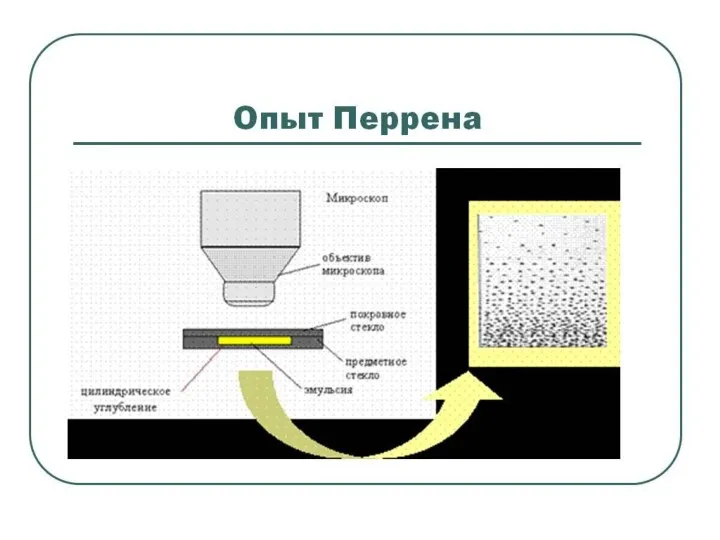
- 19. Жан Батист Перрен (1870 - 1942) В 1906 году начал проводить опыты, подтвердившие теорию Эйнштейна. Подводя
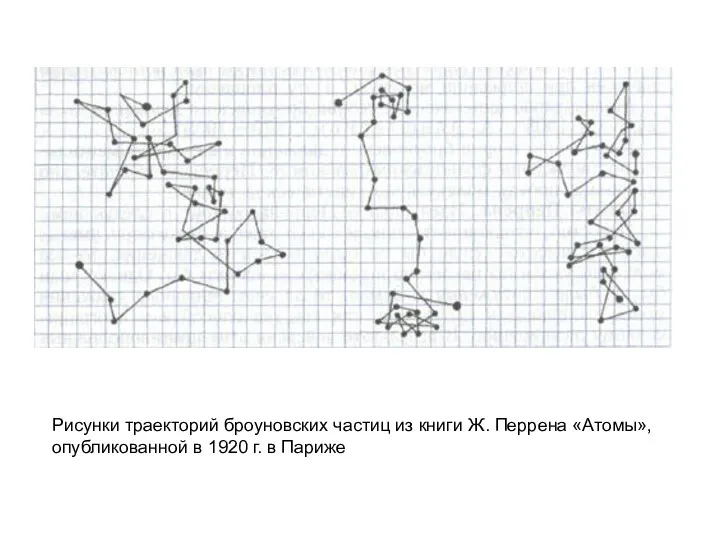
- 20. Рисунки траекторий броуновских частиц из книги Ж. Перрена «Атомы», опубликованной в 1920 г. в Париже
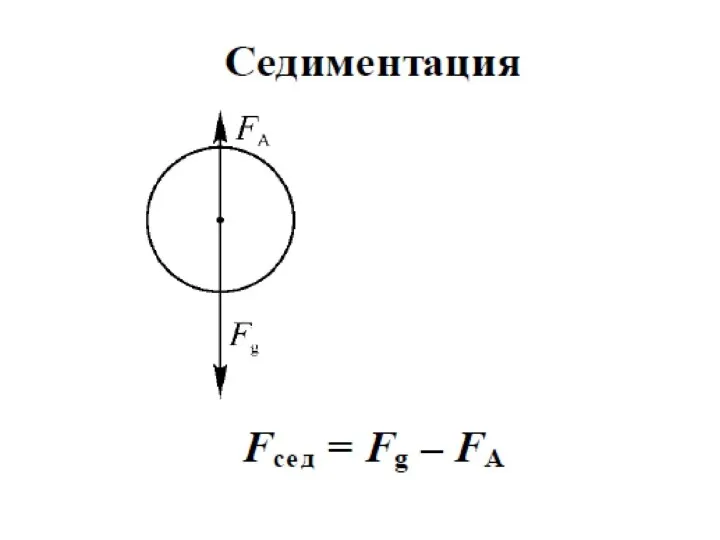
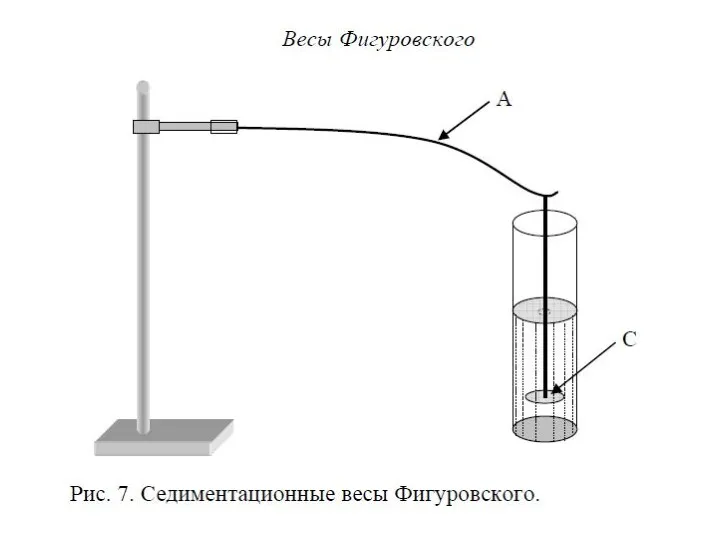
- 23. Участие частиц дисперсной фазы в броуновском движении отражается на их седиментационной способности. При оседании частиц в
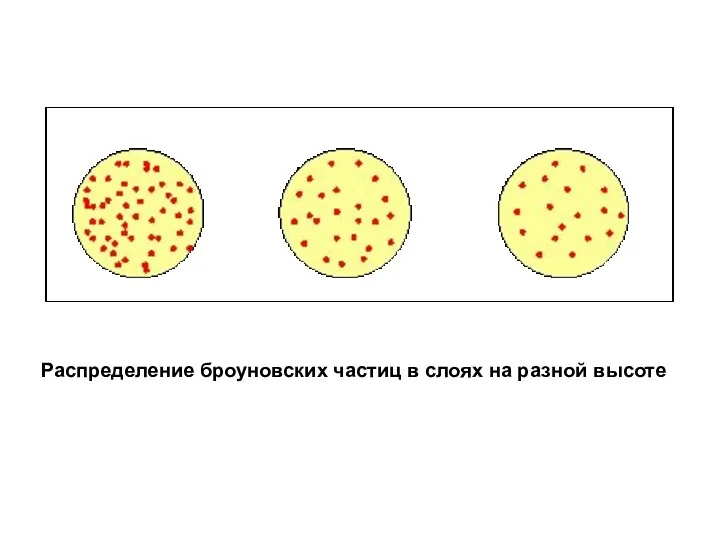
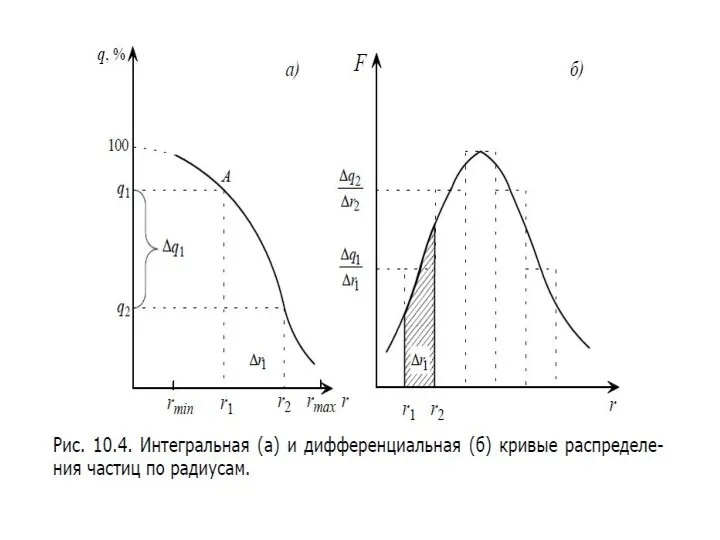
- 25. Распределение броуновских частиц в слоях на разной высоте
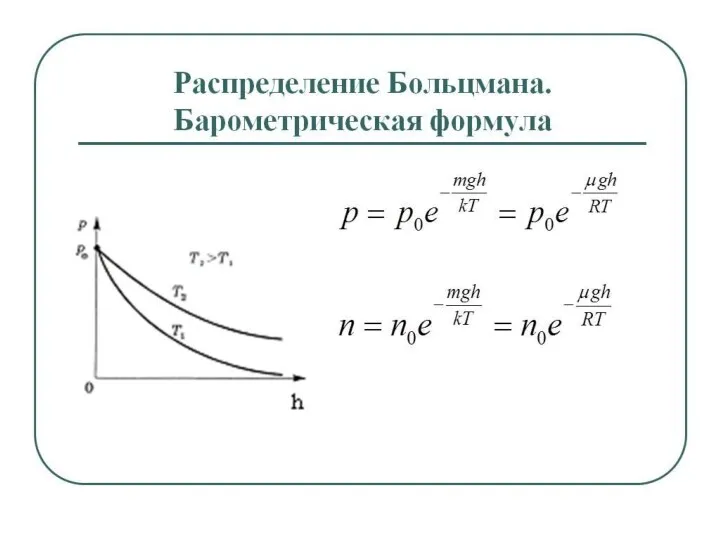
- 26. Распределение частиц при равновесии в монодисперсной системе описывается гипсометрической формулой – уравнением Лапласа – Перрена или
- 28. Коллоидные растворы золота полученные Майклом Фарадеем
- 41. Ультрацентрифуга Под действием силы тяжести оседают только крупные частицы. Коллоидные частицы оседают чрезвычайно медленно. Так, частицы
- 42. В 1923 г. Т.Сведберг и Г Ринде сконструировали ультрацентрифугу для проведения анализа золей. Эта центрифуга, делая
- 44. Время оседания в центробежном поле рассчитывается по формуле: Скорость оседания:
- 46. С точки зрения термодинамики осмос обусловлен ростом энтропии при смешении растворов. С кинетической точки зрения тем,
- 47. Молекулярно-кинетические свойства коллоидов … Осмос ‒ самопроизвольный процесс перехода растворителя через мембрану из раствора с меньшей
- 49. В коллоидных растворах также должно наблюдаться явление осмоса. Рассмотрим можно ли применять в этом случае уравнение
- 50. Величина аналогичная молярной массе в истинных растворах (масса 1 моля частиц) для коллоидных растворов будет вычисляться
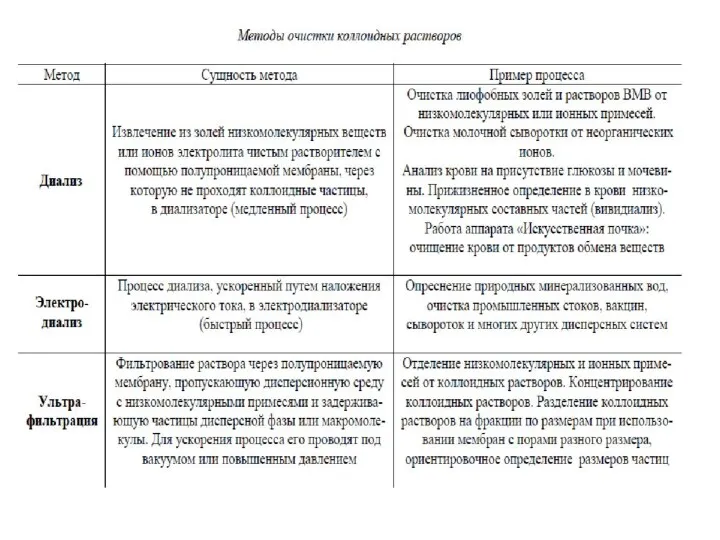
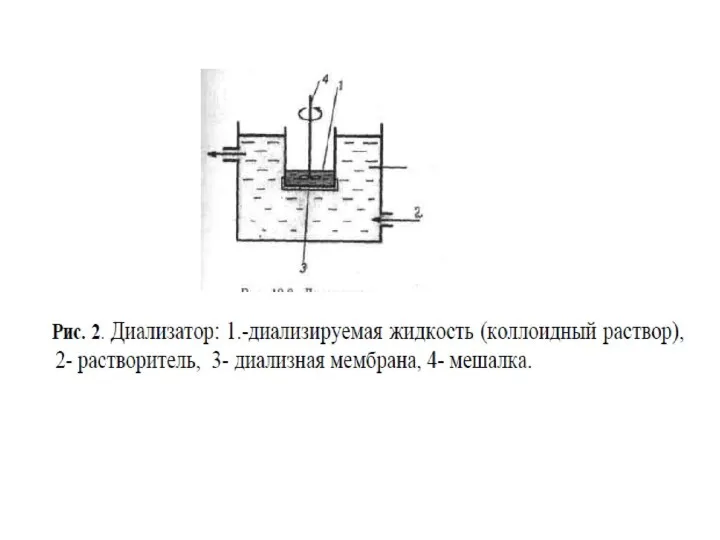
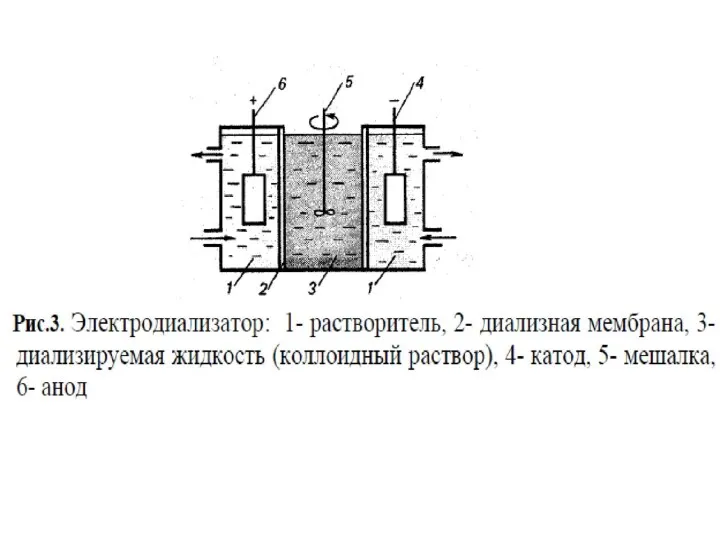
- 51. Некоторые молекулярно-кинетические свойства коллоидных систем используют для очистки золей от электролитов и молекулярных примесей, которыми полученные
- 56. Скачать презентацию




























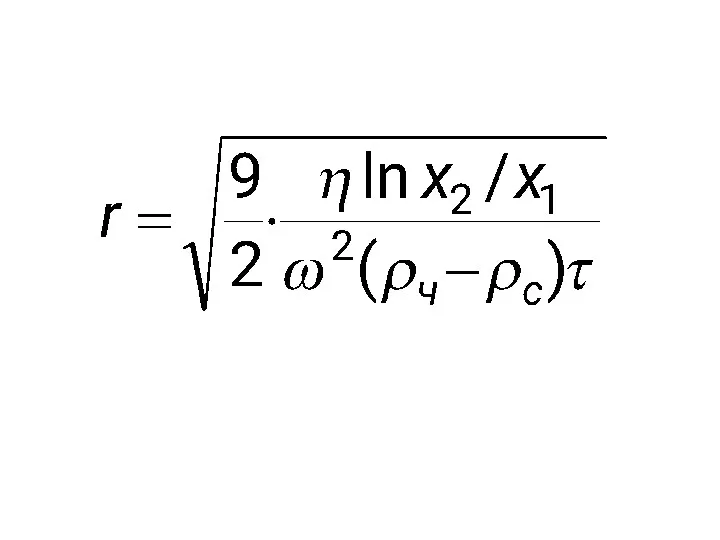








 Алюминий и его соединения
Алюминий и его соединения Проектная работа. Косметика своими руками
Проектная работа. Косметика своими руками Тайна мыльного пузыря
Тайна мыльного пузыря Жиры (триглицериды)
Жиры (триглицериды) Количество вещества. Молярная масса
Количество вещества. Молярная масса Реальные газы, жидкости и твердые тела
Реальные газы, жидкости и твердые тела Геохимия гидросферы
Геохимия гидросферы Биофизическая химия. Предмет и задачи курса
Биофизическая химия. Предмет и задачи курса Хімічний зв’язок
Хімічний зв’язок Растворы
Растворы Неорганические вещества клетки
Неорганические вещества клетки Закон сохранения массы веществ
Закон сохранения массы веществ Амины
Амины Позднемеловая трубка взрыва щелочных базальтов Красноозерная
Позднемеловая трубка взрыва щелочных базальтов Красноозерная Месторождения берилла и топаза
Месторождения берилла и топаза Теория электролитической диссоциации
Теория электролитической диссоциации Оценка химической обстановки при авариях на химически опасных объектах
Оценка химической обстановки при авариях на химически опасных объектах The halogens
The halogens Соединения щелочных металлов
Соединения щелочных металлов Ковалентний зв’язок, його утворення
Ковалентний зв’язок, його утворення Пряности глазами химика
Пряности глазами химика Қанықпаған көмірсутектердің реакцияға түсу қабілеттілігі
Қанықпаған көмірсутектердің реакцияға түсу қабілеттілігі Количество вещества. Молярная масса. Молярный объем
Количество вещества. Молярная масса. Молярный объем Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Периодический закон и Периодическая система химических элементов Д.И. Менделеева Классификация химических реакций
Классификация химических реакций Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Полимеры и пластические массы
Полимеры и пластические массы Материаловедение и технология конструкционных материалов. Полимерное материаловедение
Материаловедение и технология конструкционных материалов. Полимерное материаловедение