Содержание
- 2. Ластухін Ю.О., Воронов С.А. Органічна хімія. Підручник для вищих навчальних закладів. - Львів: Центр Європи, 2000.
- 3. Короткий екскурс в історію розвитку органічної хімії Об’єктами дослідження хімічної науки є хімічні сполуки ї їхні
- 4. Органічна хімія - це розділ хімії, що вивчає структуру (будову), властивості, методи синтезу та реакції органічних
- 5. Короткий екскурс в історію розвитку органічної хімії Основні етапи розвитку хімії. Передалхімічний період – від початку
- 6. Період кількісних законів (атомно-молекулярна теорія) 1789 – 1860р.р. Франкланд увiв поняття про валентнiсть елементiв, як властивiсть
- 7. Теорії будови органічних сполук, теорія радикалів Підставою для створення цієї теорії стали дослідження сполук ціану (Гей-Люссак,
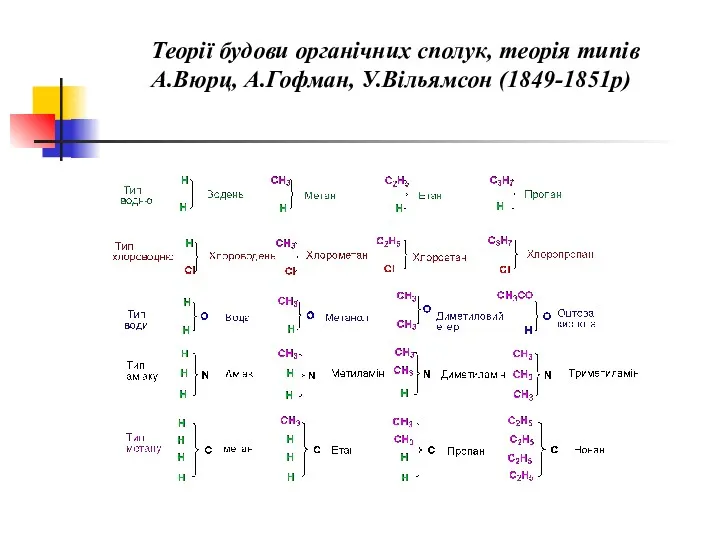
- 8. Теорії будови органічних сполук, теорія типів А.Вюрц, А.Гофман, У.Вільямсон (1849-1851р)
- 9. Незалежно один вiд одного, Ф.Кекуле i Ж-Б.Кольбе встановили, що атоми Карбону можуть з`єднуватися в ланцюги, а
- 10. Атоми в молекулах органічних речовин розташовані не безладно, а у певній послідовності, відповідно до їх валентності.
- 11. Атоми у молекулі з’єднуються один з одним за допомогою хімічних зв’язків. Чому атоми утворюють один з
- 12. Цього можна досягти трьома шляхами: 1) прийняти певну кількість електронів, що не вистачає до октету, на
- 13. Йонний зв’язок утворюється за рахунок сил електростатич-ного притягання між різнойменно зарядженими йонами. Йони утворюються, як правило,
- 14. Атом флуору, приймаючи цей електрон від атома натрію, перетворюється на аніон F¯ з електронною оболонкою наступного
- 15. Ковалентний (неелектровалентний, гомеополярний) зв`язок виникає між двома конкретними атомами в результаті утворення спільної електронної пари, яка
- 16. Якщо зв’язок утворився між атомами різних елементів, то спільна електронна пара буде належати одному з цих
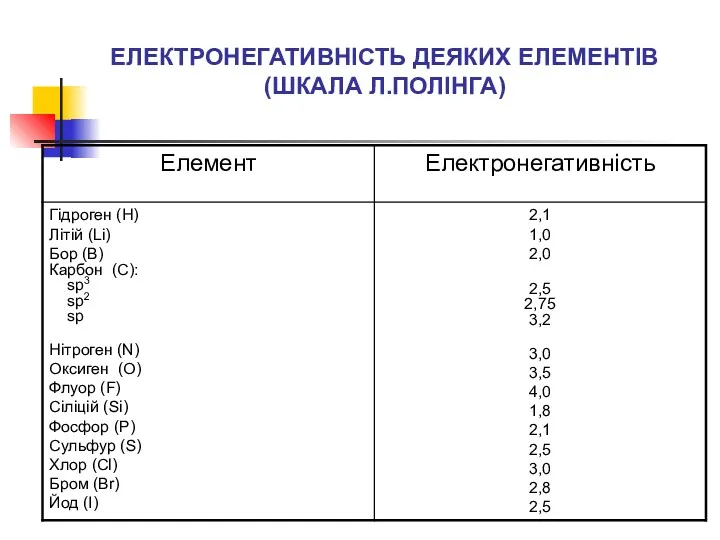
- 17. ЕЛЕКТРОНЕГАТИВНІСТЬ ДЕЯКИХ ЕЛЕМЕНТІВ (ШКАЛА Л.ПОЛІНГА)
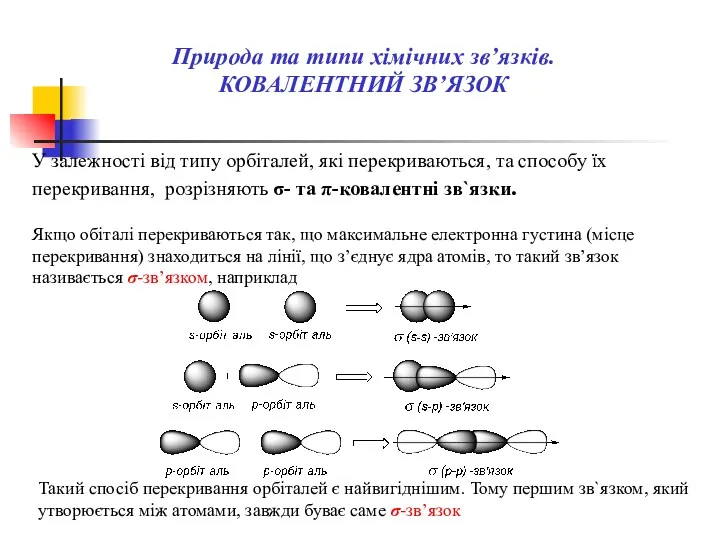
- 18. У залежностi вiд типу орбiталей, якi перекриваються, та способу їх перекривання, розрізняють σ- та π-ковалентні зв`язки.
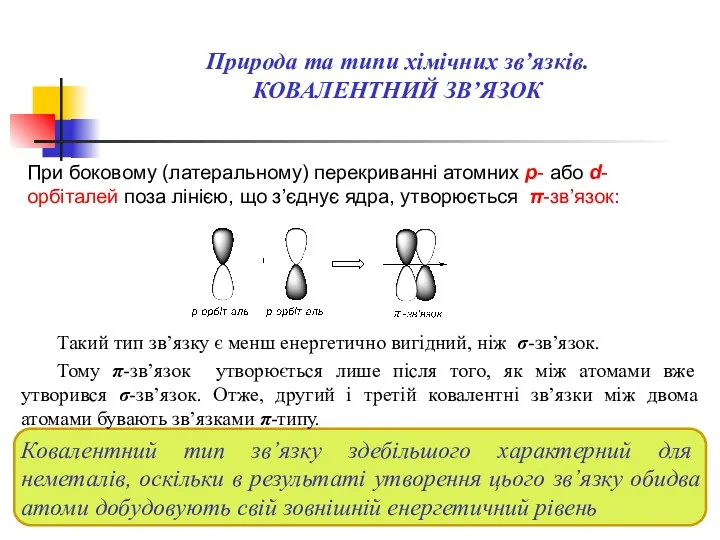
- 19. При боковому (латеральному) перекриванні атомних p- або d-орбіталей поза лінією, що з’єднує ядра, утворюється π-зв’язок: Природа
- 20. Природа та типи хімічних зв’язків. БАНАНОВИДНИЙ ЗВ’ЯЗОК
- 21. Донорно-акцепторним (координаційним або дативним) називаєть-ся ковалентний зв’язок, на утворення якого один атом (донор) надає пару електронів,
- 22. При утворенні полярного ковалентного зв'язку між атомом Гідрогену та атомом з високою електронегативністю, електронна хмара атома
- 23. У твердому, рідкому і навіть газоподібному станах молекули гідроген флуориду асоційовані у ланцюги за рахунок утворення
- 24. Між молекулами води також утворюються водневі зв’язки. Кожна молекула води може брати участь в утворенні чотирьох
- 25. Внутрішньомолекулярний водневий зв'язок виникає між атомами однієї молекули Водневий зв'язок відіграє важливу роль при асоціації молекул,
- 26. Довжина — віддаль між ядрами атомів, що утворили зв’язок; як правило, вимірюється в нанометрах (1нм =
- 27. Поляризованість – здатність зв’язку поляризуватись під дією зовнішнього електростатичного поля. Вона залежить від рухливості електронних хмар,
- 28. Сполуки з йонним зв’язком – як правило кристалічні речовини з високими температурами топлення та кипіння. Вони
- 29. Сполуки з неполярними або малополярними ковалентними зв’язками, навпаки, характеризуються невисокими температурами топлення та кипіння. Це пов’язано
- 31. Відомо, що при збудженні атома під дією тепла або світлового випромінювання один електрон з 2s-підрівня переходить
- 32. Однак, відомо, що в метані (СН4), атом С утворює чотири рівноцінні зв'язки з чотирма атомами водню.
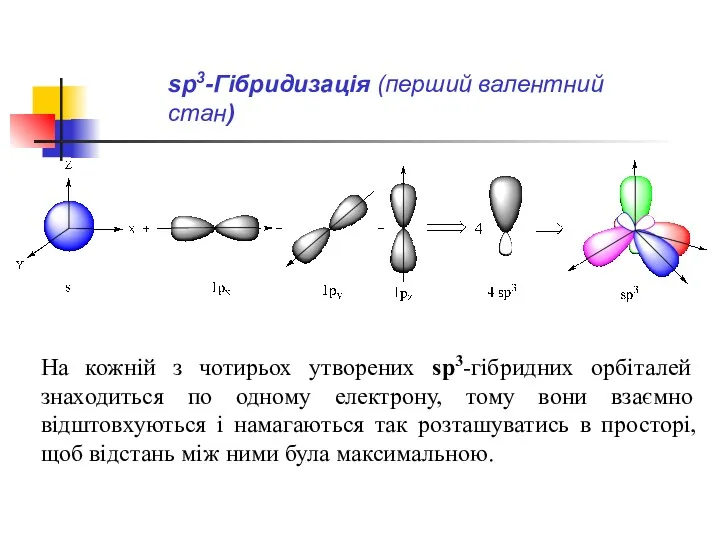
- 33. На кожній з чотирьох утворених sp3-гібридних орбіталей знаходиться по одному електрону, тому вони взаємно відштовхуються і
- 34. Цій умові відповідає їх напрямленість до вершин тетраедра, центр якого співпадає з ядром атома Карбону Валентні
- 35. Необхідно пам'ятати, що гібридні орбіталі мають вищу енергію, ніж s- і р-орбіталі, але за рахунок ефективнішого
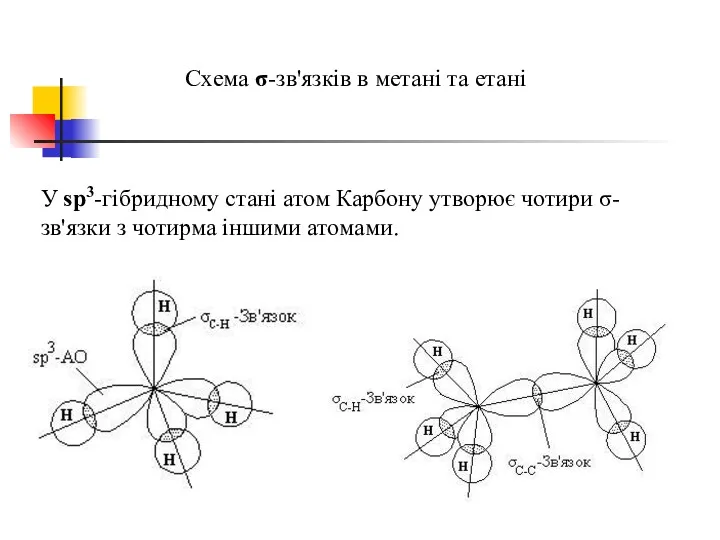
- 36. Схема σ-зв'язків в метані та етані У sp3-гібридному стані атом Карбону утворює чотири σ-зв'язки з чотирма
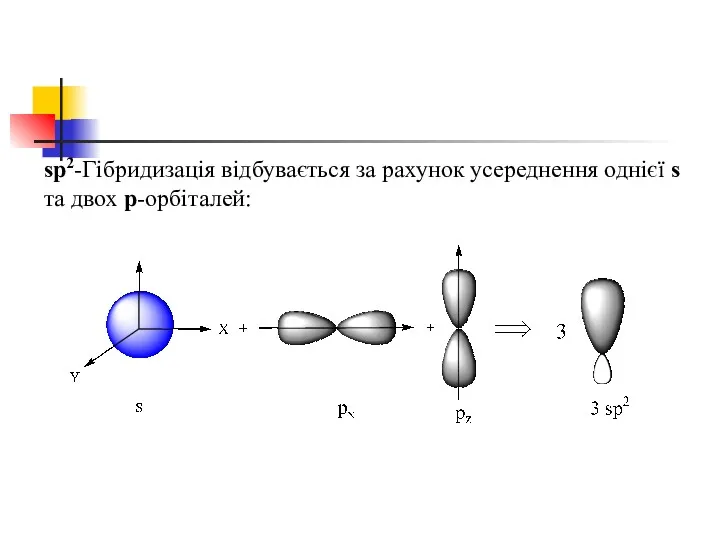
- 37. sр2-Гібридизація відбувається за рахунок усереднення однієї s та двох p-орбіталей:
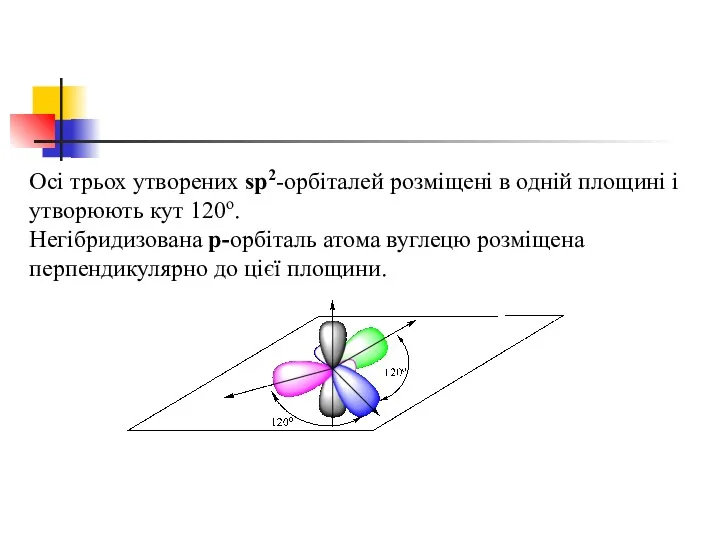
- 38. Осі трьох утворених sр2-орбіталей розміщені в одній площині і утворюють кут 120o. Негібридизована р-орбіталь атома вуглецю
- 39. Стан sр2-гібридизації називається другим валентним станом. В цьому гібридному стані атом Карбону утворює три σ і
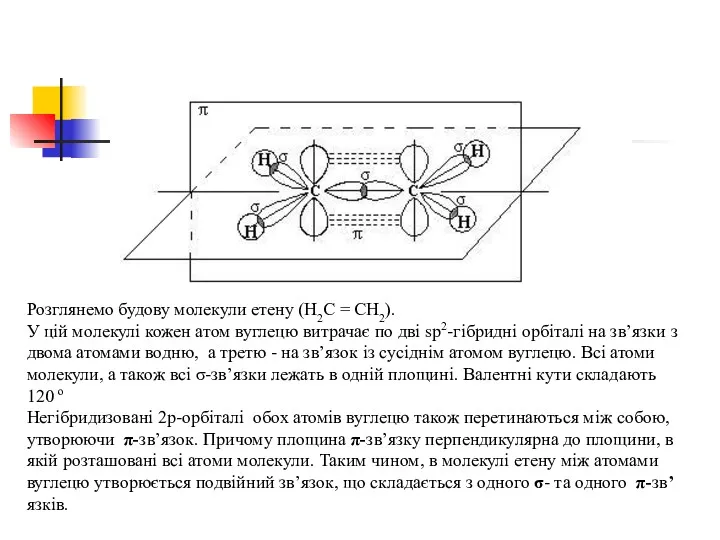
- 40. Розглянемо будову молекули етену (Н2С = СН2). У цій молекулі кожен атом вуглецю витрачає по дві
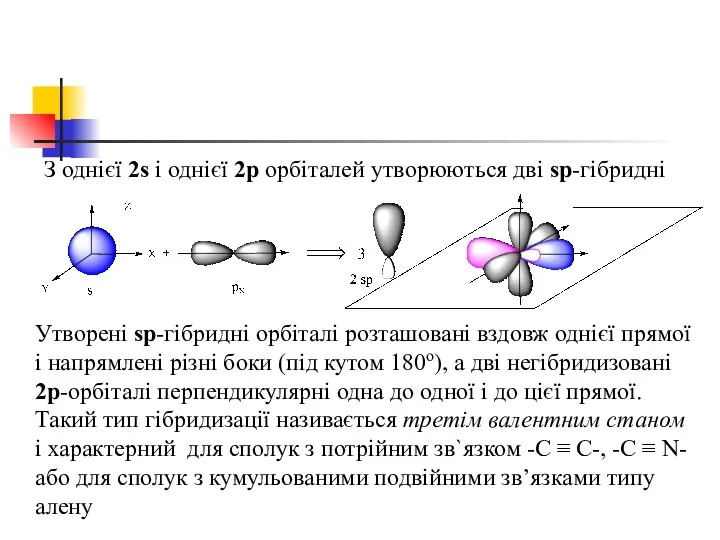
- 41. З однієї 2s і однієї 2р орбіталей утворюються дві sр-гібридні Утворенi sр-гібридні орбiталi розташовані вздовж однієї
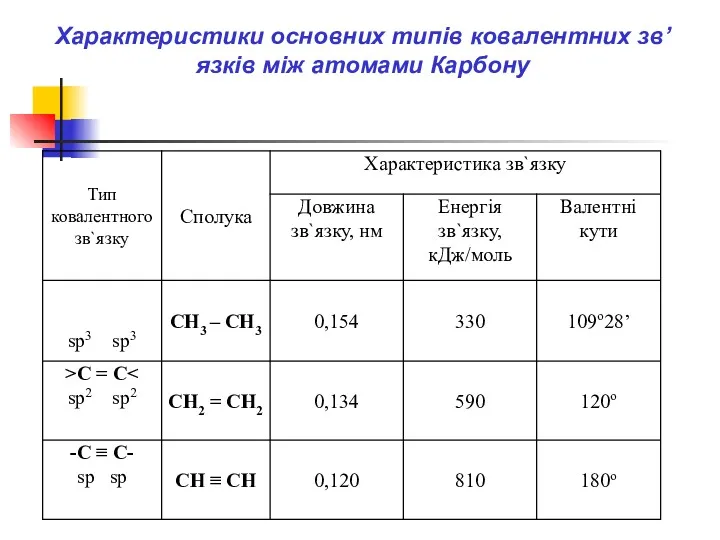
- 42. Характеристики основних типів ковалентних зв’язків між атомами Карбону
- 44. Скачать презентацию






























 Адсорбция на пористых адсорбентах. Пористость. Методы получения пористых материалов. Лекция 7
Адсорбция на пористых адсорбентах. Пористость. Методы получения пористых материалов. Лекция 7 Азот. Строение атома и молекулы
Азот. Строение атома и молекулы Скорость химических реакций. Молекулярные гонки
Скорость химических реакций. Молекулярные гонки Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Өндірілетін және тиелетін өнімнің сапасын бақылау, оларға қойылатын талаптар
Өндірілетін және тиелетін өнімнің сапасын бақылау, оларға қойылатын талаптар Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність
Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність Кислород
Кислород Алюминий және оның қосылыстары
Алюминий және оның қосылыстары Металлы – простые вещества
Металлы – простые вещества Предельные углеводороды ( 10 класс )
Предельные углеводороды ( 10 класс ) Пластмассы
Пластмассы Алкени та алкіни
Алкени та алкіни Кислород. Химия. 8 класс
Кислород. Химия. 8 класс Химическая связь. Виды химической связи
Химическая связь. Виды химической связи Массовая доля вещества в растворе. 8 класс
Массовая доля вещества в растворе. 8 класс Прочность полимеров
Прочность полимеров Изотопы. История открытия. Изотопы водорода
Изотопы. История открытия. Изотопы водорода Бытовая химия
Бытовая химия Спирты
Спирты Подготовка к ОГЭ по химии
Подготовка к ОГЭ по химии Золото
Золото Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Аккумуляторные батареи
Аккумуляторные батареи Types of chemical bonds in crystals
Types of chemical bonds in crystals Гидрирование альдегидов и кетонов
Гидрирование альдегидов и кетонов Основания. 8 класс
Основания. 8 класс Предмет и задачи физической химии
Предмет и задачи физической химии