Протолитическая теория кислот и оснований. Протолитическое равновесие. Буферные растворы. Лекция 01 презентация
Содержание
- 2. Лекция №1 Лектор: кандидат химических наук, доцент Иванова Надежда Семёновна Протолитическая теория кислот и оснований. Протолитическое
- 3. Синквейн 1я строка – существительное (дисциплина) 2я строка – 2 прилагательных (признаки и свойства существительного) 3я
- 4. Основная литература Ершов Ю.А., Попков В.А. Общая химия. Биофизическая химия. Химия биогенных элементов Издательство: Высшая школа,
- 5. Основная литература Попков В.А., Пузаков С.А. Общая химия Издательство: ГЭОТАР-Медиа, 2007.- 976 с.
- 6. Основная литература Ленский А.С. Биофизическая и бионеограническая химия Издательство: МИА, 2008. – 416 с. Издательство: ВШ,
- 7. Основная литература Пузаков С.А. Химия Издательство: ГЭОТАР-Медиа, 2006.- 640 с.
- 8. Основная литература Слесарев В.И. Химия. Основы химии живого Издательство: Химиздат, 2009. – 784 с.
- 9. Дополнительная литература Глинка Н.Л. Общая химия Издательство: любое
- 10. Дополнительная литература Тюрина Е.Ф., Иванова Н.С. Общая химия. Вопросы и ответы Издательство: Медицина ДВ, 2008. -
- 11. Дополнительная литература Иванова Н.С., Мусина С.А. Введение в химию биогенных элементов Издательство: Полисфера, 2005. – 89
- 12. Дополнительная литература Тюрина Е.Ф. Химия. Теоретические основы. Вопросы. Тесты. Задачи с решениями Издательство: Медицина ДВ, 2008.
- 13. Дополнительная литература Харвуд Л., Мак-Кендрик Дж., Уайтхед Р. Наглядная органическая химия Издательство: «ГОЭТАР-Медиа», 2010г. – с.120.
- 14. Дополнительная литература Сонина Г.П. Практические умения по биоорганической химии Издательство: Медицина ДВ, 2005г.
- 15. Введение В результате метаболизма в организме образуется большое количество кислот, а больше всего Н2СО3 (до 13
- 16. Теория Бренстеда − Лаури (Б-Л), предложенная в 1923 г., определяет кислоты и основания по отношению к
- 17. Кислоты и основания Б-Л Кислота − протон-донорное вещество. Основание − протон-акцепторное вещество. Из этого можно записать
- 18. Тогда протолитическое равновесие может быть выражено схемой: Направление протолитического равновесия устанавливается в результате конкуренции за Н+
- 19. СН3СОО− Типы кислот и оснований Б-Л СН3СООН NH3 NH4+ SO42− HSO4−
- 20. Типы протолитических реакций Для сопряжённой кисл.−осн. пары Ka ⋅ Kb =10−14 ⇒ чем сильнее кислота в
- 21. Физиологические механизмы поддержания рН крови Реагируют на изменение рН через 2 – 3 суток Реагируют на
- 22. Физико-химические механизмы поддержания рН крови Буферное действие проявляется практически мгновенно (10 – 15 мин). Ионный обмен.
- 23. Буферные системы – … … раствор, содержащий протолитическую равновесную систему, способную поддерживать практически постоянный рН при
- 24. Состав буферных систем Из определения в состав буферной системы входит слабый протолит: НА + Н2О ↔
- 25. Типы буферных систем кислая буферная система: слабая кислота и её соль с сильным основанием СН3СООН +
- 26. Расчёт рН буферных систем. Уравнение Гендерсона – Гассельбаха кислая буферная система основная буферная система
- 27. Из уравнения очевидно: рН буферной системы определяется Ка или Кb слабого протолита: рКа = –lgKa pKb
- 28. … и основные свойства буфера (противостоять изменению рН при добавлении сильных протолитов и разбавлению) заключаются в
- 29. При добавлении HCl СН3СООН СН3СОО– + Н+ ↔ СН3СООН HCl заменяется эквивалентным количеством СН3СООН, что приводит
- 30. Механизм действия бикарбонатного буфера
- 31. Основные характеристики буферной системы Буферная ёмкость (В, β) ‒ количество вещества эквивалента сильного протолита Х, которое
- 32. Факторы, влияющие на β Концентрации компонентов буферной системы: чем выше концентрации, тем выше β. ?????????????????????? Соотношение
- 33. Основные характеристики буферной системы Зона буферного действия ‒ интервал значений рН, в котором сохраняется буферное действие
- 34. рН биожидкостей в норме Внутриклеточный рН Внутри эритроцита рН ~ 7,20 – 7,30 Внеклеточный рН Нормальный
- 35. Совмещённые протолитические равновесия … … в буферной системе имеют место при одновременном присутствии в ней нескольких
- 36. Совмещённое протолитическое равновесие Н+ В– А– Вывод: в совмещённом протолитическом равновесии доминирует тот процесс, в результате
- 38. Скачать презентацию
 Окислительно-восстановительные электроды
Окислительно-восстановительные электроды Поверхностная модификация дисперсных систем
Поверхностная модификация дисперсных систем Методы сжигания газа. Раздел 3
Методы сжигания газа. Раздел 3 Мына қосылыстардағы элементтердің тотығу дәрежелерін анықтаңдар
Мына қосылыстардағы элементтердің тотығу дәрежелерін анықтаңдар Химические свойства кислот
Химические свойства кислот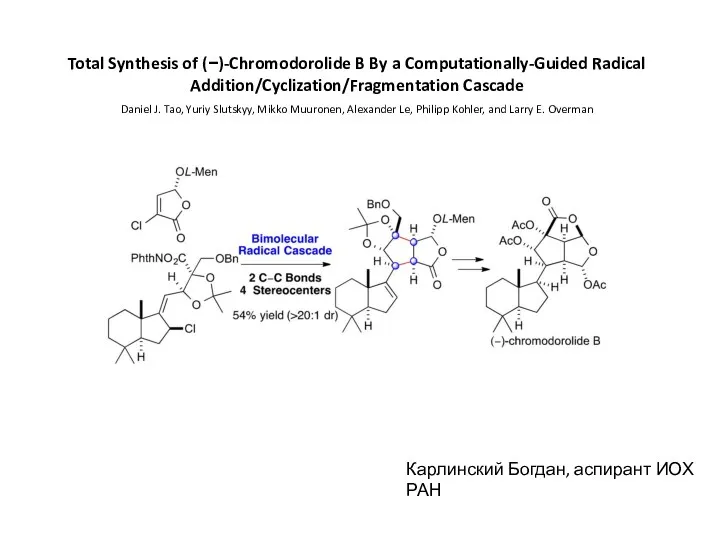 Total Synthesis of (−)-Chromodorolide B By a Computationally-Guided Radical
Total Synthesis of (−)-Chromodorolide B By a Computationally-Guided Radical Геохимическая классификация элементов
Геохимическая классификация элементов Серебро. Нахождение в природе
Серебро. Нахождение в природе Азотная кислота и ее свойства
Азотная кислота и ее свойства Строение атома углерода. Валентные состояния атома углерода
Строение атома углерода. Валентные состояния атома углерода Электрохимия. Понятие о двойном электрическом слое (ДЭС)
Электрохимия. Понятие о двойном электрическом слое (ДЭС) Строение атома
Строение атома Пластмассы в автомобилестроении
Пластмассы в автомобилестроении Производство серы из природного газа и продукты на ее основе
Производство серы из природного газа и продукты на ее основе Пластмаси та їх роль у сучасному виробництві
Пластмаси та їх роль у сучасному виробництві Физико-химические методы анализа. Лекция 3
Физико-химические методы анализа. Лекция 3 Каталитический синтез нуклеозидов и других пребиотических производных формамида при протонном облучении метеоритов
Каталитический синтез нуклеозидов и других пребиотических производных формамида при протонном облучении метеоритов Химическая стойкость тугоплавких металлов в различных реагентах
Химическая стойкость тугоплавких металлов в различных реагентах Роль металлов в нашей жизни
Роль металлов в нашей жизни Физические свойства минералов
Физические свойства минералов Електроліз. Найпоширеніші способи застосування
Електроліз. Найпоширеніші способи застосування Буферные растворы
Буферные растворы Дисперсные системы и растворы
Дисперсные системы и растворы Қайтымды реакция. Химиялық тепе-теңдік
Қайтымды реакция. Химиялық тепе-теңдік 20231004_agregatnye_sostoyaniya_-_kopiya
20231004_agregatnye_sostoyaniya_-_kopiya Чисті речовини і суміші
Чисті речовини і суміші Обобщение по теме Неметаллы
Обобщение по теме Неметаллы Теоретические основы химической технологии переработки природных энергоносителей и углеводородных материалов
Теоретические основы химической технологии переработки природных энергоносителей и углеводородных материалов