Содержание
- 2. Обобщение и систематизация знаний по теме: « Растворение. Растворы. Свойства растворов электролитов».
- 3. Задание №1 «Дальше, дальше, дальше». 1. Основоположник теории электролитической диссоциации ________________ 2. Процесс распада электролита на
- 4. Ответы: 1. Основоположник теории электролитической диссоциации (Аррениус). 2. Процесс распада электролита на ионы называется…(Электролитическая диссоциация). 3.
- 5. Собрать вещества из данного списка парами: CuO, H2SO4, NaOH, H3PO4, P2O5, Cu(OH)2 , SO3, Na2O. Задание
- 6. H2SO4- SO3; H3PO4 - P2O5, Кислота – кислотный оксид NaOH - Na2O, Cu(OH)2 - CuO, Основание
- 7. Задание 3 «Эксперимент» 1.Из имеющихся реактивов получите сульфат бария. Составьте уравнение реакции в молекулярном и ионном
- 8. Ответ: Na2 SO4 + BaCl2 = 2NaCl + BaSO4 Na2CO3 + 2HCl = 2NaCl + CO2
- 9. Задание № 4 «Эрудит». Задача К 27 г раствора с массовой долей хлорида меди (II) 10
- 10. CuCl2 + Na2S = CuS↓ + 2NaCl m (CuCl2) = m(p-pа) · ω/100 = 27 ·
- 11. Задание 5. «Подумай». Из предложенного ряда веществ: H2O, K2O, NaOH, SO2, HCl, BaCl2 выпишите те вещества,
- 12. Правильный ответ: MgSO4 + 2NaOH = Mg(OH)2 ↓ + Na2SO4 MgSO4 + BaCl2 = BaSO4↓ +
- 13. Домашнее задание: Повторить §35 – 42, стр.253, № 5
- 14. Продолжите предложение: Сегодня на уроке мне понравилось… Сегодня на уроке мне не понравилось… Своей работой на
- 16. Скачать презентацию













 Коррозия металлов
Коррозия металлов Химическая связь. Кристаллические решетки. (Лекция 2.2)
Химическая связь. Кристаллические решетки. (Лекция 2.2) Пегматитовые месторождения
Пегматитовые месторождения Характеристики химического процесса. Степень превращения, селективность, выход продукта. (Лекция 1.2)
Характеристики химического процесса. Степень превращения, селективность, выход продукта. (Лекция 1.2) Агрегатные состояния вещества
Агрегатные состояния вещества Химическая связь
Химическая связь Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Су қоймасындағы тіршілік үшін темірдің рөлі
Су қоймасындағы тіршілік үшін темірдің рөлі Crystal structure and surface phase composition of palladium oxides thin films for gas sensors
Crystal structure and surface phase composition of palladium oxides thin films for gas sensors Кафедра химической технологии лекарственных веществ (ХТЛВ)
Кафедра химической технологии лекарственных веществ (ХТЛВ) Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Значення хімії у розв’ язанні енергетичної проблеми
Значення хімії у розв’ язанні енергетичної проблеми Электродные процессы
Электродные процессы Углеводы (сахариды)
Углеводы (сахариды) Ациклические углеводороды
Ациклические углеводороды Пластмасса
Пластмасса Производные галогенуглеводородов жирного ряда, спиртов, простых и сложных эфиров, альдегидов
Производные галогенуглеводородов жирного ряда, спиртов, простых и сложных эфиров, альдегидов Химиялық термодинамиканың негіздері. Негізгі түсініктері мен зандары. Термохимиялық есептеулер
Химиялық термодинамиканың негіздері. Негізгі түсініктері мен зандары. Термохимиялық есептеулер Бензин. Физико-химические свойства бензина
Бензин. Физико-химические свойства бензина Биологически важные пяти- и шестичленные гетероциклы с одним и двумя гетероатомами
Биологически важные пяти- и шестичленные гетероциклы с одним и двумя гетероатомами Состав воздуха. Тема 1
Состав воздуха. Тема 1 Коррозия металлов
Коррозия металлов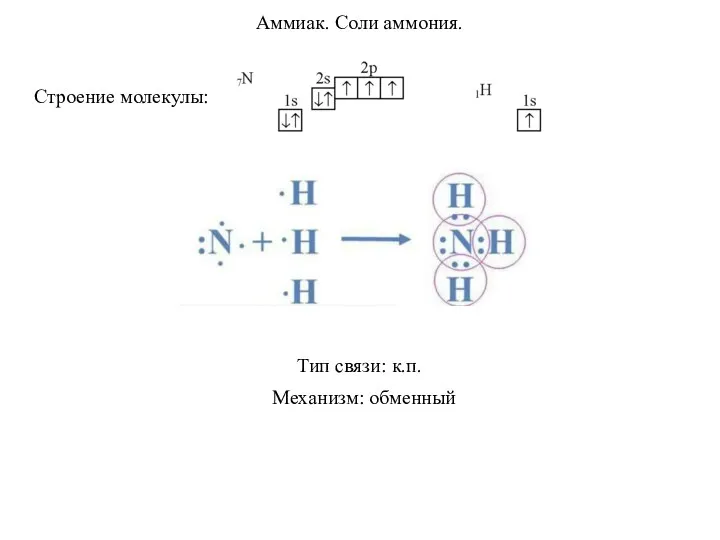 Аммиак. Соли аммония
Аммиак. Соли аммония Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник
Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии
Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии Основания (3)
Основания (3) Предмет органической химии. Основные положения теории химического строения органических соединений
Предмет органической химии. Основные положения теории химического строения органических соединений Сахароза
Сахароза