Содержание
- 2. ВМС (высокомолекулярные соединения) – это соединения, состоящие из большого числа (повторяющихся - в случае полимера) элементарных
- 3. n имеет значения от нескольких десятков до сотен тысяч и более. Полимеры с высокой степенью полимеризации
- 4. Классификации ВМС 1. По происхождению они могут быть: природные (натуральные): большая группа ВМС: белки и их
- 5. Искусственные полимеры получают из природных путем химической модификации. К ним относятся нитроцеллюлоза, ацетатное, вискозное волокна, хлоркаучук
- 6. 2. По числу разных видов мономеров, образующих полимер, различают: гомополимеры (все звенья одинаковы): например, крахмал, гликоген
- 7. Гомоцепные - полимеры, главные цепи которых состоят только из атомов углерода (карбоцепные)…-CH2-CH2-CH2-CH2-…, кремния (полисиланы) …-SiH2-SiH2-SiH2-SiH2- …,
- 8. 3. По природе мономеров ВМС можно поделить на: органические; неорганические: полисиланы, полигерманы, кварц (SiO2)n, алмаз (С)n,
- 9. Белый фосфор имеет форму тетраэдра Р4, при нагревании до 500°С переходит в полимерное состояние – красный
- 10. элементорганические – в цепь включен любой элемент, кроме азота, кислорода, серы. а) соединения, цепи которых состоят
- 11. б) соединения, имеющие цепи неорганической природы. Например, R R R R R ׀ ׀ ׀ ׀
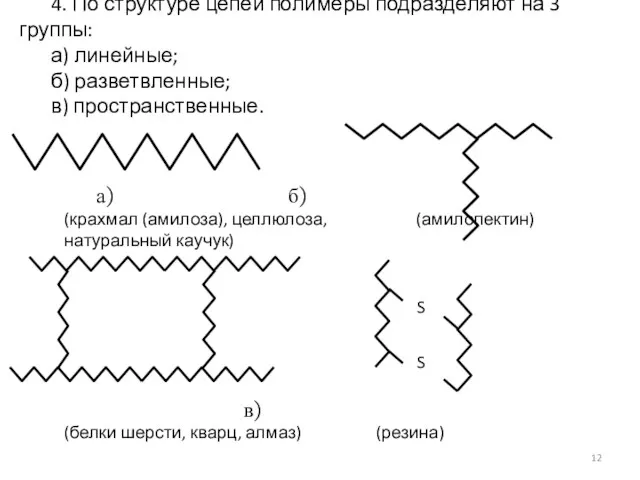
- 12. 4. По структуре цепей полимеры подразделяют на 3 группы: а) линейные; б) разветвленные; в) пространственные. а)
- 13. 5. По способности к электролитической диссоциации ВМС делятся на: неэлектролиты (полиэтилен), полиэлектролиты (белки). В свою очередь
- 14. 6. По механическим свойствам: Эластомеры (каучуки, резины) – ВМС с высокоэластичными свойствами; (эластичность – способность восстанавливать
- 15. 7. По применению в фармации: Лекарственные вещества (пепсин, панкреатин, трипсин, стрептодеказа и др. Вспомогательные вещества (стабилизаторы
- 16. Полидисперсность полимеров ВМС представляют собой смеси макромолекул с различной длиной цепи, иногда и различной структуры. Такую
- 17. Разделение на отдельные полимергомологи (фракционирование) в виде нескольких фракций, каждая из которых значительно менее полидисперсна, чем
- 18. Молекулярную массу полимеров в основном определяют в их разбавленных растворах. Для этого используют методы: осмометрии, вискозиметрии,
- 19. Агрегатные, фазовые и физические состояния ВМС
- 20. Агрегатные и фазовые состояния В термодинамике фаза – часть системы, отделенная от другой части поверхностью раздела
- 21. НМС Понятия агрегатного и фазового состояния совпадают: Твердое (дальний порядок - порядок, в сотни и тысячи
- 22. ВМС Агрегатные состояния: Твердое (ближний и дальний порядок) Жидкое (ближний порядок) Фазовые состояния: Кристаллическое: ВМС находятся
- 23. Физические состояния Аморфное фазовое состояние для линейного полимера имеет три физических состояния: стеклообразное состояние характеризуется наименьшей
- 24. Границами раздела физических состояний служат две температурные точки: - температура стеклования Тс, являющаяся средним значением температурной
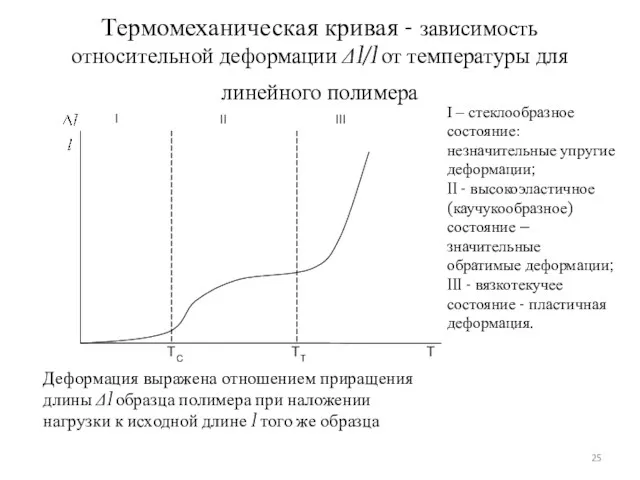
- 25. Термомеханическая кривая - зависимость относительной деформации Δl/l от температуры для линейного полимера I – стеклообразное состояние:
- 26. На температуры переходов влияют: молекулярная масса; химическое строение полимера. Так, жесткоцепные полимеры не имеют высокоэластического состояния.
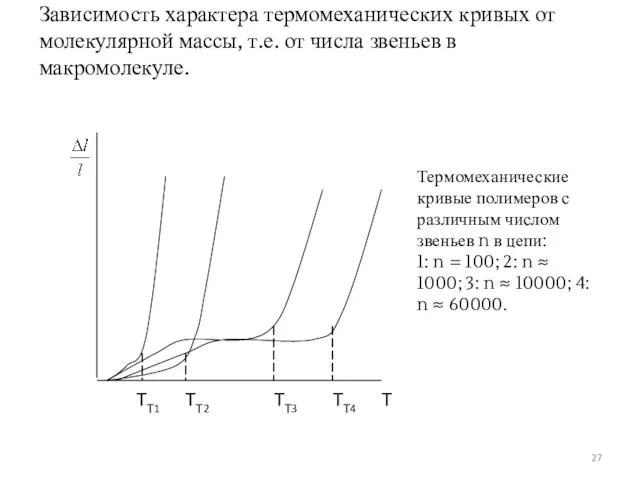
- 27. Зависимость характера термомеханических кривых от молекулярной массы, т.е. от числа звеньев в макромолекуле.
- 28. Температура стеклования почти не зависит от общей длины цепи. Температура текучести ТТ, отвечающая началу движения полимерных
- 29. Особенности физико-химических свойств ВМС и полимеров 1) Не летучи. 2) Не перегоняются с водяным паром. 3)
- 30. Специфические свойства полимеров обусловлены главным образом двумя особенностями: большой молекулярной массой; существованием двух типов связей –
- 31. РАСТВОРЫ ВМС
- 32. Растворы ВМС (высокомолекулярных соединений) – лиофильные дисперсные системы, с молярной массой частиц равной или больше 10
- 33. Свойства растворов ВМС Набухание Увеличение объема и массы полимера за счет поглощения им какого-то количества растворителя.
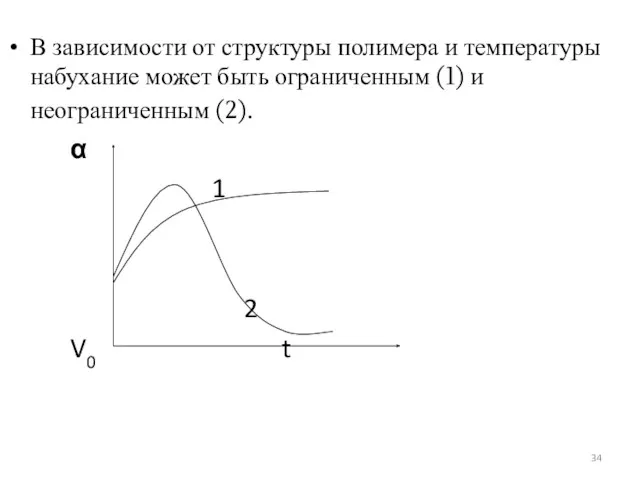
- 34. В зависимости от структуры полимера и температуры набухание может быть ограниченным (1) и неограниченным (2). α
- 35. 2. Набухание зависит от температуры и степени измельченности - прямопропорционально. Факторы, влияющие на набухание Природа полимера
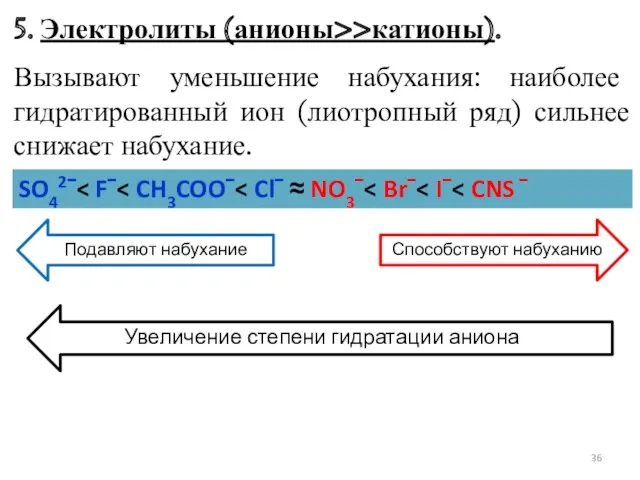
- 36. 5. Электролиты (анионы>>катионы). Вызывают уменьшение набухания: наиболее гидратированный ион (лиотропный ряд) сильнее снижает набухание. SO42ˉ
- 37. Образование ассоциатов в концентрированных растворах ВМС при слиянии водных оболочек без объединения самих частиц. Коацервация может
- 38. Микрокапсулы представляют собой заключенные в оболочку из полимера твердые, жидкие или газообразные лекарственные вещества. Микрокапсулирование лекарств
- 39. Осмотическое давление при одинаковой массовой концентрации зависит от размера частиц и определяется по формуле: π1/ π2
- 40. Многие ВМС являются полиэлектролитами, а некоторые из них и полиамфолитами (белки). В зависимости от рН среды
- 41. Для ИЭТ характерно: свертывание белка в клубки; уменьшение: вязкости, гидратации, набухания, растворимости, осмотического давления, электропроводности, дзета-потенциала;
- 42. Вязкость – это сила сопротивления (трения), между слоями текущей жидкости, обусловленная силами сцепления между молекулами жидкости.
- 43. Причины аномальной вязкости растворов ВМС. Изменение ориентации в потоке частиц удлиненной формы и макромолекул. Структурообразование –
- 44. Факторы, влияющие на вязкость Природа (М, форма макромолекул) Природа растворителя. 3) Концентрация раствора ВМС. 4) Температура.
- 45. Устойчивость растворов полимеров и ее нарушение Основными факторами устойчивости растворов ВМС является: наличие дзета-потенциала и наличие
- 46. Для разрушения раствора ВМС требуется большая концентрация электролита, при этом протекает обратимый процесс и наблюдается неподчинение
- 47. Денатурация – разрушение структуры белка с потерей нативных свойств. Денатурацию вызывают: а/ нагревание свыше 60°, многократное
- 48. При денатурации наблюдается: Изменение вторичной, третичной и четвертичной структуры белка. Уменьшение растворимости. Изменение формы и размеров
- 49. Следствием нарушения агрегативной устойчивости, приводящим к структурообразованию является застудневание. Студнеобразное состояние является одной из форм существования
- 50. Защитное действие коллоидов. Коллоидная защита – процесс увеличения устойчивости гидрофобных золей под действием гидрофильных полимеров. Эффективность
- 52. Скачать презентацию












































 Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Небезпечні хімічні речовини
Небезпечні хімічні речовини Неделя химии в МБОУ Андреевская ООШ
Неделя химии в МБОУ Андреевская ООШ Бытовая химия
Бытовая химия Определение окисляемости воды
Определение окисляемости воды Химические тест-методы анализа экологических проб. Лекция 6
Химические тест-методы анализа экологических проб. Лекция 6 Практическая работа. Химический состав клетки
Практическая работа. Химический состав клетки Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Растворы электролитов и неэлектролитов. (Лекция 2)
Растворы электролитов и неэлектролитов. (Лекция 2) Физико-химические свойства алкенов
Физико-химические свойства алкенов Поверхностная активность и поверхностно активное вещество
Поверхностная активность и поверхностно активное вещество Кислородсодержащие соединения азота
Кислородсодержащие соединения азота История нефти. Свойства нефти. Классификация нефтей
История нефти. Свойства нефти. Классификация нефтей Стекло, его виды и классификация
Стекло, его виды и классификация Химические методы выявления потожировых следов
Химические методы выявления потожировых следов Пищевые добавки
Пищевые добавки Альдегиды и кетоны
Альдегиды и кетоны Изомеры и гомологи
Изомеры и гомологи Бензол. Физические и химические свойства
Бензол. Физические и химические свойства проект по биологииНаучно-исследовательская работа
проект по биологииНаучно-исследовательская работа Самоспалахування. Фактори, що впливають на температуру самоспалахування. Лекція 5
Самоспалахування. Фактори, що впливають на температуру самоспалахування. Лекція 5 Строение, свойства и классификация аминокислот. Лекция 2
Строение, свойства и классификация аминокислот. Лекция 2 Вплив хімічних сполук на довкілля
Вплив хімічних сполук на довкілля Chemical Equilibrium. Topic 3.3
Chemical Equilibrium. Topic 3.3 Щелочные металлы и их соединения. 9 класс
Щелочные металлы и их соединения. 9 класс Воспользуйтесь ЛСМ Химические реакции
Воспользуйтесь ЛСМ Химические реакции Chem reactions. Different Typesof Chemical Reactions
Chem reactions. Different Typesof Chemical Reactions Химический состав клетки. Неорганические соединения
Химический состав клетки. Неорганические соединения