π-комплексы металлов. Природа связи металлуглерод в π-комплексах металлов. Отличия в свойствах от обычной σ-связи презентация
Содержание
- 2. π-комплексы титана (титаноцены) Титан образует циклопентадиенильные, индиенильные и циклогептатриенильные соединения. Титаноцен дихлорид – ярко-красное твердое вещество,
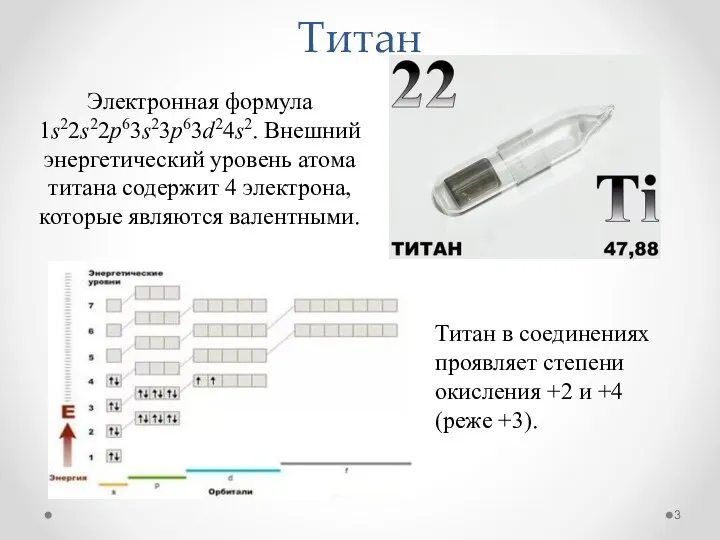
- 3. Титан Электронная формула 1s22s22p63s23p63d24s2. Внешний энергетический уровень атома титана содержит 4 электрона, которые являются валентными. Титан
- 4. Строение Ренттгено-структурные исследования показали, что атом Ti располагается между двумя плоскими циклопентадиенильными кольцами. В титаноцене циклопентадиенильные
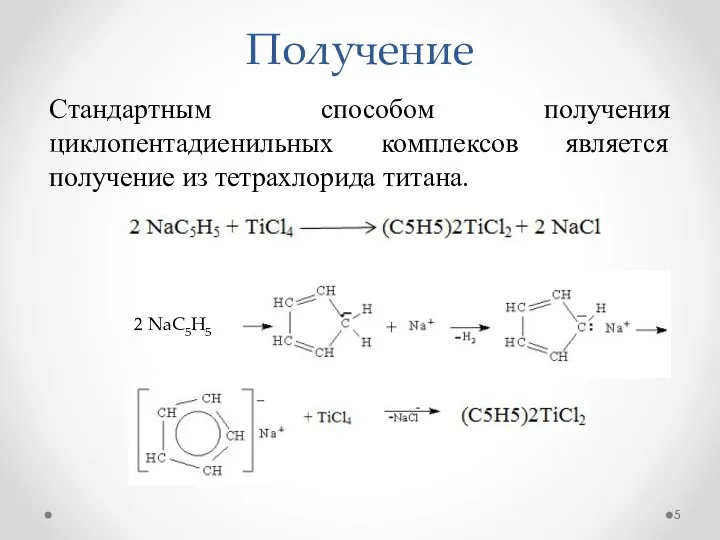
- 5. Получение Стандартным способом получения циклопентадиенильных комплексов является получение из тетрахлорида титана. 2 NaC5H5
- 6. Титаноцен дихлорид также можно получить, используя свежеперегнанный циклопентадиен, а не его натриевое производное: Получение смешанных бис(циклопентадиенил)-алкоксихлортитаны:
- 7. Химические свойства Трифенилсиланолят натрия реагирует с бис(циклопентадиенил)дихлортитанидом: Получение реагента Петасиса: Реакцию проводят в диэтиловом эфире.
- 8. Сравнение π-связи с σ-связью Ti-C Циклопентадиенильные соединения устойчивее и менее реакционноспособны по сравнению с титанорганическими соединениями
- 9. История открытия металлоценов В 1952 г. Т. Кили и П. Посоном случайно получили соединение, которое позже
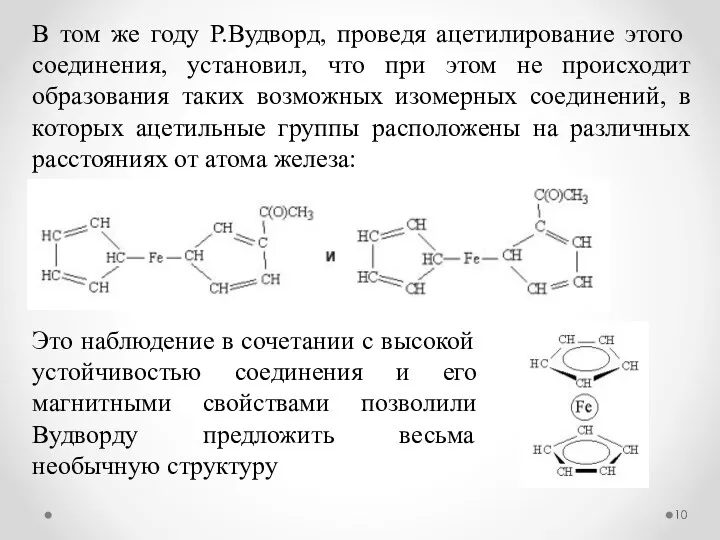
- 10. В том же году Р.Вудворд, проведя ацетилирование этого соединения, установил, что при этом не происходит образования
- 12. Скачать презентацию






 Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування
Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування Катионы IV аналитической группы
Катионы IV аналитической группы Строение атома и периодический закон. (Тема 2)
Строение атома и периодический закон. (Тема 2) Қазақстанда химияны оқыту әдістемесінің даму тарихы
Қазақстанда химияны оқыту әдістемесінің даму тарихы Химическая промышленность
Химическая промышленность Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів
Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів Природній та супутній нафтові гази, їх склад, використання
Природній та супутній нафтові гази, їх склад, використання Кислород/водород. Повторение
Кислород/водород. Повторение Лаборатория красивых волос
Лаборатория красивых волос Аммиак (9 класс)
Аммиак (9 класс) ферментер
ферментер Гидролиз солей
Гидролиз солей Химические свойства и получение алканов
Химические свойства и получение алканов Механическая смесь и растворы
Механическая смесь и растворы Химическая связь и ее типы. Кристаллические решётки
Химическая связь и ее типы. Кристаллические решётки Массовая доля элемента в веществе
Массовая доля элемента в веществе Цинк и его применение
Цинк и его применение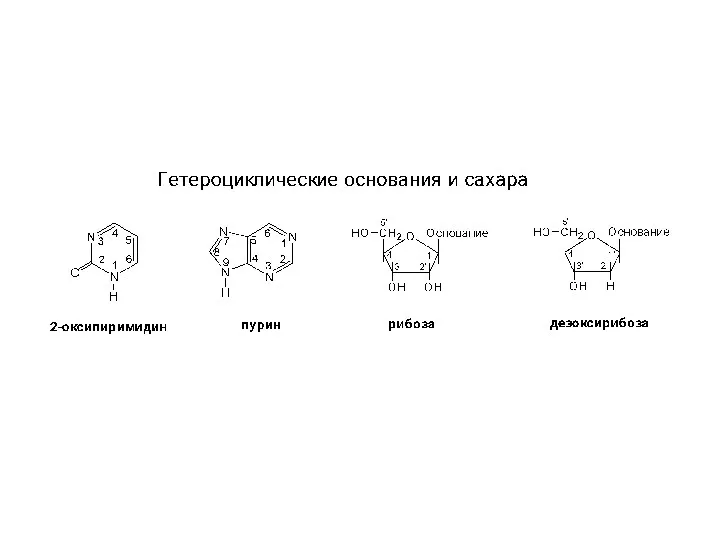 Структура гетероциклов, нуклеозидов и нуклеотидов
Структура гетероциклов, нуклеозидов и нуклеотидов Химические уравнения Закон сохранения массы веществ
Химические уравнения Закон сохранения массы веществ Кислотно-основное титрование в неводных средах
Кислотно-основное титрование в неводных средах Пластические массы и изделия на их основе
Пластические массы и изделия на их основе Химические уравнения
Химические уравнения p-элементы 17 группы периодической системы: галогены
p-элементы 17 группы периодической системы: галогены Химия и проблемы экологии. Кислотные дожди
Химия и проблемы экологии. Кислотные дожди Тотығу-тотықсыздану титрлеу әдісі
Тотығу-тотықсыздану титрлеу әдісі Химическая связь в кластерах
Химическая связь в кластерах Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования Ionic polymerization
Ionic polymerization