Содержание
- 2. Алкены (олефины) —алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна двойная связь. общая
- 3. Гомологический ряд алкенов:
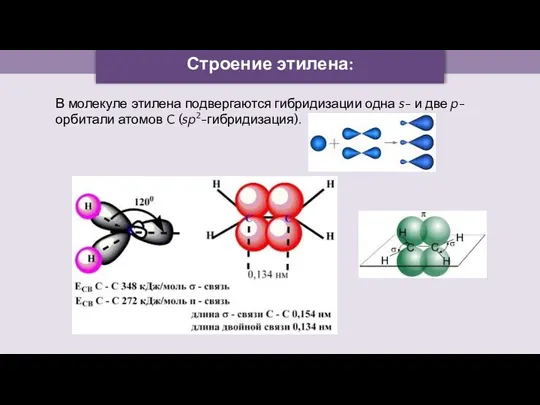
- 4. Строение этилена: В молекуле этилена подвергаются гибридизации одна s- и две p-орбитали атомов C (sp2-гибридизация).
- 5. Строение этилена: Запомните! SP2 –гибридизация: 1) Плоское тригональное строение 2) Угол – HCH - 120° 3)
- 6. Изомерия алкенов: Структурная изомерия: 1. Изомерия углеродного скелета (начиная с С4Н8): 2. Изомерия положения двойной связи
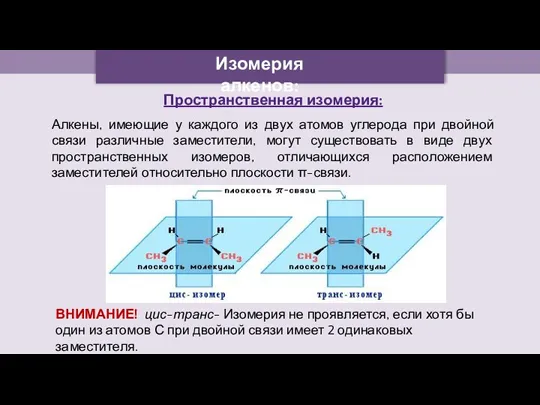
- 7. Изомерия алкенов: Пространственная изомерия: Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные
- 8. Номенклатура алкенов: По систематической номенклатуре названия этиленовых углеводородов производят заменой суффикса -ан в соответствующих алканах на
- 9. Номенклатура алкенов: Правила составления названий алкенов по международной номенклатуре (ИЮПАК): 1. Найти наиболее длинную (главную) цепь
- 10. Номенклатура алкенов: Правила составления названий алкенов по международной номенклатуре (ИЮПАК): 2. Пронумеровать атомы углерода главной цепи
- 11. Номенклатура алкенов: Правила составления названий алкенов по международной номенклатуре (ИЮПАК): 3. Назвать заместители (алкильные радикалы) в
- 12. Номенклатура алкенов: Правила составления названий алкенов по международной номенклатуре (ИЮПАК): 4. Цифрой указать положение двойной связи
- 13. Физические свойства • C2 – C4 – газы, C5 - C16 – жидкости, высшие алкены –
- 14. Химические алкенов: Наличие подвижной, легко поляризуемой π–связи приводит к тому, что алкены легко вступают в реакции
- 15. Химические алкенов: 3. Гидрогалогенирование (присоединение галогеноводородов): 2. Галогенирование (присоединение галогенов): Реакция с бромной водой является качественной
- 16. Химические алкенов: Присоединение галогеноводородов к алкенам несимметричного строения происходит по правилу В.В. Марковникова. Присоединение против правила
- 17. Химические алкенов: Также в присутствии какого-либо органического пероксида полярные молекулы галогеноводородов реагируют с алкенами не по
- 18. Химические алкенов: 4. Гидратация (присоединение воды): Присоединение воды к несимметричным алкенам идет по правилу Марковникова.
- 19. Химические алкенов: 5. Реакции полимеризации: Число n называется степенью полимеризации. Реакции полимеризации алкенов идут в результате
- 20. Химические алкенов: 6. Реакции окисления: 1). Горение: А) Полное (избыток О2). Газообразные гомологи алкенов образуют с
- 21. Химические алкенов: 6. Реакции окисления: 2). Неполное каталитическое окисление: 3). Окисление перманганатом калия в нейтральной или
- 22. Химические алкенов: 6. Реакции окисления: 4). Окисление перманганатом калия в кислой среде:
- 23. Химические алкенов: 7. Изомеризация алкенов: Алкены вступают в реакцию изомеризации при нагревании в присутствии катализаторов (Al2O3).
- 24. Получение алкенов: В промышленности: 1.Крекинг алканов (протекает по свободнорадикальному механизму при высоких температурах (400о-700оС)): 2.Дегидрирование алканов
- 25. Получение алкенов: В лаборатории: 1.Дегидротация спиртов:: При внутримолекулярной дегидратация вторичных и третичных спиртов атом водорода отрывается
- 26. Получение алкенов: В лаборатории: 2. Дегидрогалогенирование моногалогеналканов действием спиртового раствора щелочи (происходит по правилу Зайцева) 3.
- 28. Скачать презентацию























 Полімери. Будова і властивості полімерів
Полімери. Будова і властивості полімерів Индикаторы кислотно-основного титрования
Индикаторы кислотно-основного титрования Высокомолекулярные соединения полимеры
Высокомолекулярные соединения полимеры Композиты как материалы конструкционного назначения
Композиты как материалы конструкционного назначения Синтетические моющие средства
Синтетические моющие средства Получение и химические свойства оснований
Получение и химические свойства оснований Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Электронно-ионный баланс и Закон Авогадро. 8 класс
Электронно-ионный баланс и Закон Авогадро. 8 класс Классификация органических соединений. Урок химии в 10 классе
Классификация органических соединений. Урок химии в 10 классе Материаловедение и методы диагностики микро- и наноструктурных материалов
Материаловедение и методы диагностики микро- и наноструктурных материалов Соли. Классификация. Физические и химические свойства. Получение и применение солей
Соли. Классификация. Физические и химические свойства. Получение и применение солей Alkynes
Alkynes Воздух и его состав. Урок химии. 8 класс
Воздух и его состав. Урок химии. 8 класс Пластмаси. Пластичні маси
Пластмаси. Пластичні маси Спирты. Лекция
Спирты. Лекция Генетическая связь между классами неорганических соединений. Урок 1
Генетическая связь между классами неорганических соединений. Урок 1 Введение. Методы и средства обучения химии
Введение. Методы и средства обучения химии Проект узла регенерации растворителя уксусной кислоты производства терефталевой кислоты
Проект узла регенерации растворителя уксусной кислоты производства терефталевой кислоты Промежуточные фазы в металлических сплавах
Промежуточные фазы в металлических сплавах Изомерия
Изомерия Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс
Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс Сульфидтер. Аз еруші сульфидтер
Сульфидтер. Аз еруші сульфидтер Галогены. Химические свойства. Применение
Галогены. Химические свойства. Применение Кислоты. Яблочная кислота
Кислоты. Яблочная кислота Теоретические основы биоорганической химии
Теоретические основы биоорганической химии Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Контроль качества лекарственных средств производных спиртов и альдегидов
Контроль качества лекарственных средств производных спиртов и альдегидов Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції
Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції