Содержание
- 2. Учиться и, когда придет время, прикладывать усвоенное к делу — разве это не прекрасно! Конфуций
- 3. Сказка про … кислоту. Она родилась в самой волшебной, в самой удивительной стране – в химической
- 4. «Азотная кислота и ее соли.» Тема урока:
- 5. Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса: 4KNO3 + 2(FeSO4 · 7H2O)
- 6. По основности: одноосновная По содержанию «О»: кислородсодержащая По растворимости в воде: растворимая По стабильности: нестабильная По
- 7. O H O N структурная O H +N+5O-23 молекулярная 1.1 Строение молекулы
- 8. 2.Физические свойства HNO3
- 9. 1.Лабороторный способ получения. NaNO3 + H2SO4(конц) t NaHSO4 + HNO3 Действием конц. серной кислоты на кристаллические
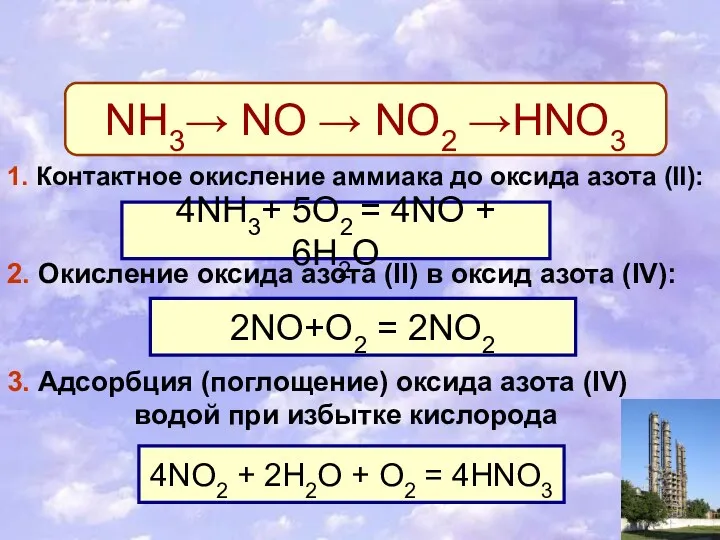
- 10. 2. Промышленный способ получения. NH3→ NO → NO2 →HNO3 1. Контактное окисление аммиака до оксида азота
- 11. «Азотная кислота по характеру среди своих подруг - самая сильная и уверенная в себе . Внешне
- 12. I. Общие с другими кислотами НNO3 + лакмус фиолетовый → НNO3 + метиловый оранжевый → Действие
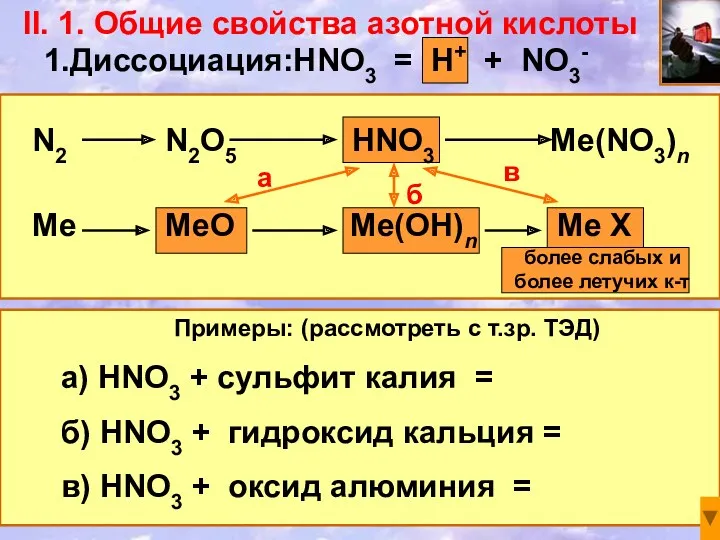
- 13. II. 1. Общие свойства азотной кислоты N2 N2O5 HNO3 Me(NO3)n Me MeO Me(OH)n Me X 1.Диссоциация:HNO3
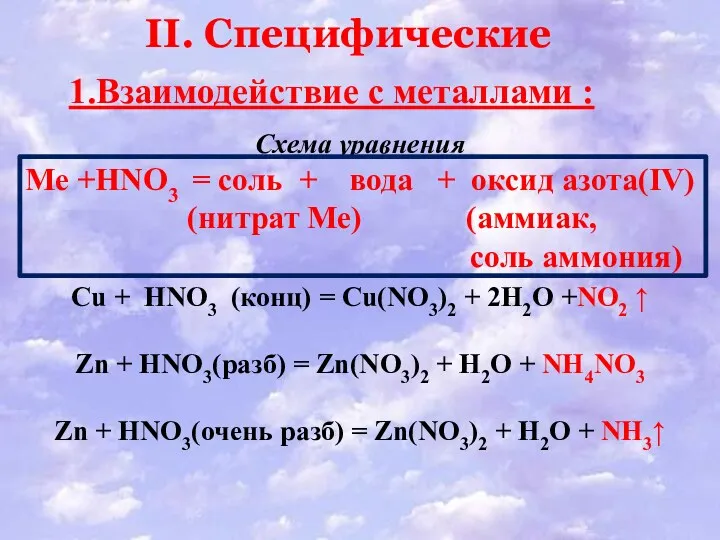
- 14. Схема уравнения Ме +HNO3 = соль + вода + оксид азота(IV) (нитрат Ме) (аммиак, соль аммония)
- 15. Особые свойства Cu +4HNO3(конц) = Cu(NO3)2 +2NO2↑ +2H2O При нагревании выделяется бурый газ, он ядовит для
- 16. 1 5 4 6 2 3 Производство азотных и комплексных удобрений. Производство взрывчатых веществ Производство красителей
- 17. Как называются соли азотной кислоты? нитраты Нитраты K, Na, NH4+ называют селитрами Составьте формулы перечисленных солей:
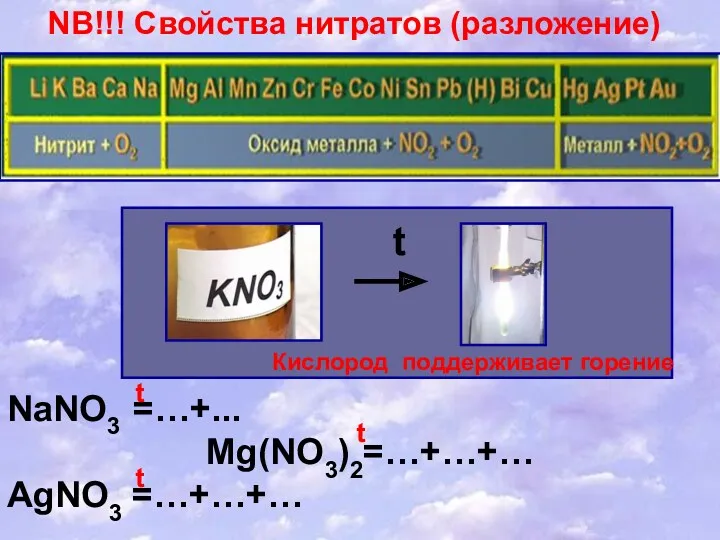
- 18. NB!!! Свойства нитратов (разложение) t Кислород поддерживает горение NaNO3 =…+... Mg(NO3)2=…+…+… AgNO3 =…+…+… t t t
- 19. Нитрат калия (калиевая селитра) Бесцветные кристаллы.Значительно менее гигроскопична по сравнению с натриевой, поэтому широко применя-ется в
- 20. Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение
- 21. Да -Нетка ? 1. Азотная кислота является сильным окислителем. 2. Азотная кислота взаимодействует только с растворимыми
- 23. Скачать презентацию
















 Растворы. Термодинамика процесса растворения. Способы выражения концентрации. Идеальные растворы. Законы Рауля
Растворы. Термодинамика процесса растворения. Способы выражения концентрации. Идеальные растворы. Законы Рауля Фосфор красный, белый и черный
Фосфор красный, белый и черный Переработка угля
Переработка угля Виды химических реакций
Виды химических реакций Супрамолекулярний контроль для дослідження реакційної здатності та каталізу
Супрамолекулярний контроль для дослідження реакційної здатності та каталізу Алкени і алкіни
Алкени і алкіни Полимеры. Классификация. Строение
Полимеры. Классификация. Строение Лигандообменные равновесия и процессы. Строение комплексных соединений
Лигандообменные равновесия и процессы. Строение комплексных соединений Моделирование, как метод научного исследования. Ограниченный метод Хартри-Фока
Моделирование, как метод научного исследования. Ограниченный метод Хартри-Фока Дисперсные системы
Дисперсные системы Азот и его соединения. Повторение
Азот и его соединения. Повторение Металлы. Определения. Положение в периодической системе. Металлы в алхимии
Металлы. Определения. Положение в периодической системе. Металлы в алхимии Полимерлер-біздің болашағымыз
Полимерлер-біздің болашағымыз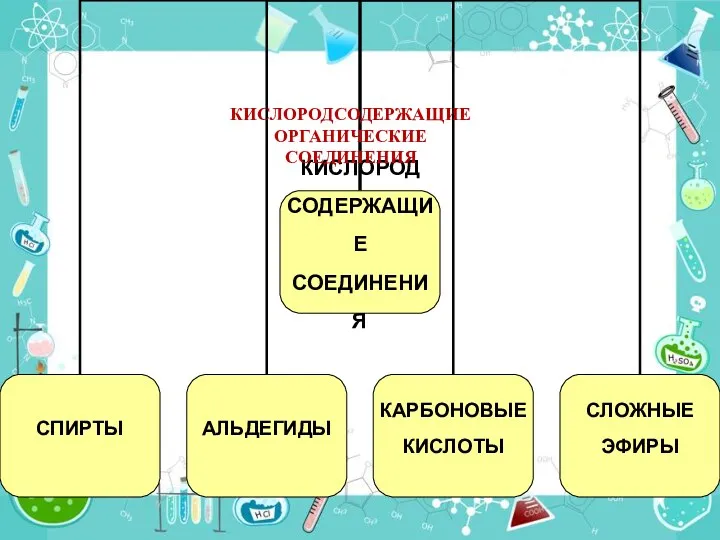 Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Водород
Водород Расчеты по химическим уравнениям. Алгоритм решения расчетных задач
Расчеты по химическим уравнениям. Алгоритм решения расчетных задач Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Теория сильных и слабых электролитов
Теория сильных и слабых электролитов Защита металлов от коррозии
Защита металлов от коррозии Решение комбинированных задач. Задачи на смеси
Решение комбинированных задач. Задачи на смеси Аммиак. Соли аммония
Аммиак. Соли аммония Apparatus of installations with circulating ball catalyst
Apparatus of installations with circulating ball catalyst Циклоалканы
Циклоалканы Ароматические азотсодержащие соединения
Ароматические азотсодержащие соединения Электролитическая диссоциация
Электролитическая диссоциация Атомы и молекулы. Простые и сложные вещества. 8 класс
Атомы и молекулы. Простые и сложные вещества. 8 класс Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ
Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ Гидросульфит натрия (пищевая добавка Е222)
Гидросульфит натрия (пищевая добавка Е222)