Содержание
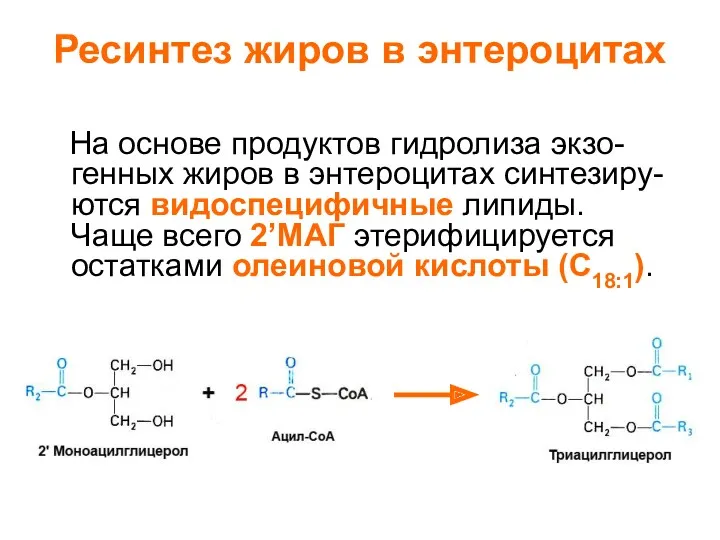
- 2. Ресинтез жиров в энтероцитах На основе продуктов гидролиза экзо- генных жиров в энтероцитах синтезиру- ются видоспецифичные
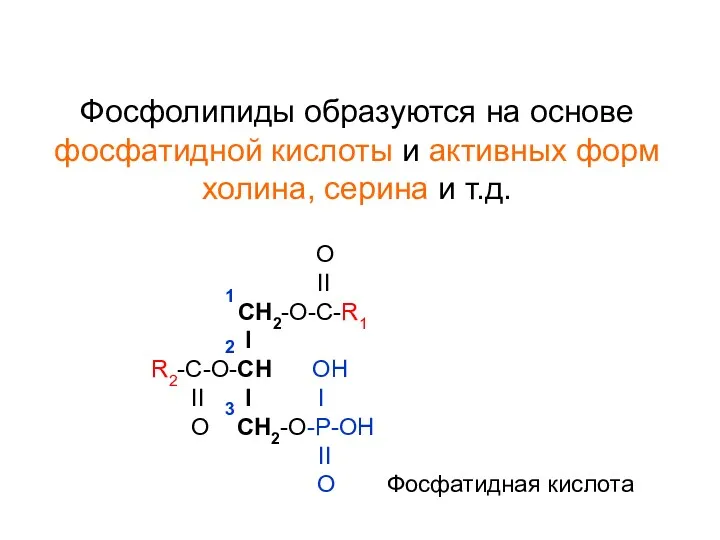
- 3. Фосфолипиды образуются на основе фосфатидной кислоты и активных форм холина, серина и т.д. O II СН2-О-С-R1
- 4. Транспортные формы экзогенных липидов * Глицерол и СЖК (С * СЖК (С>10) покидают энтероциты через кишечную
- 5. ХМ – транспортная форма экзогенных липидов ХМ образуются в энтероцитах: * Незрелые ХМ (насцентные) – 85%
- 6. * В кровяном русле незрелые ХМ получа-ют от ЛПВП апо-Е, апо-С-II (кофактор ЛПЛ) и апо-А-IV. Этим
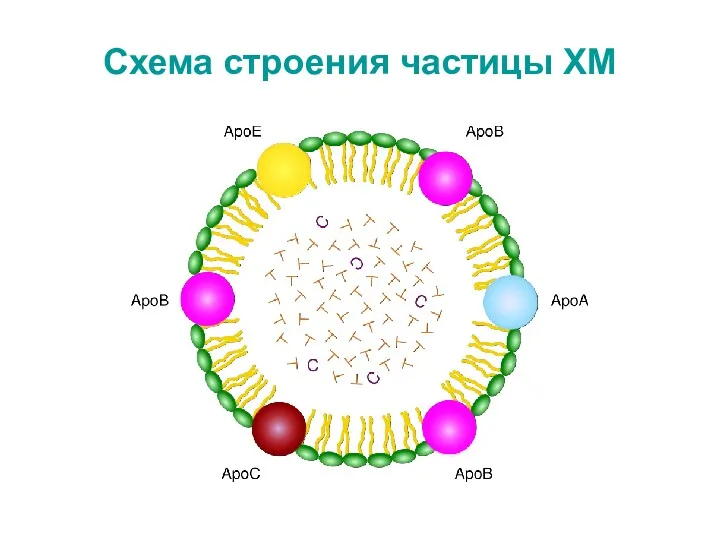
- 7. Схема строения частицы ХМ
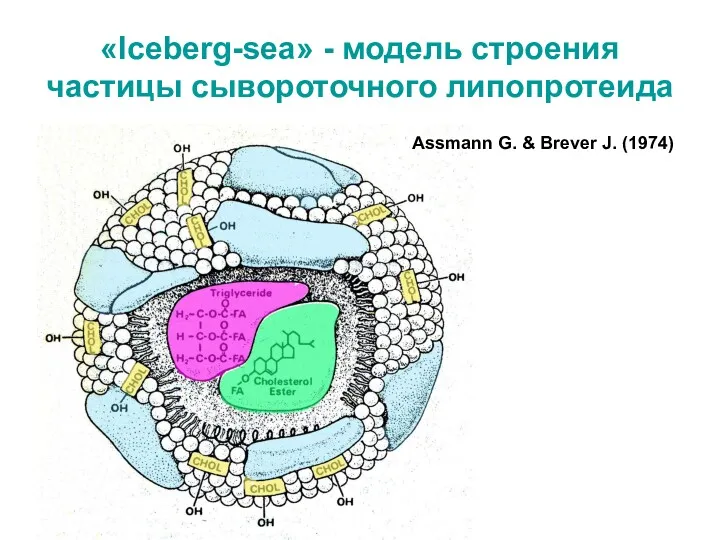
- 8. «Iceberg-sea» - модель строения частицы сывороточного липопротеида Assmann G. & Brever J. (1974)
- 9. Функции ХМ * ХМ доставляют экзогенные липиды в печень, жировую ткань, миокард и скелетные мышцы. ТАГ
- 10. ХМ, отдав часть ТАГ в результате их гидро-лиза ЛПЛ, превращаются в ремнантные ХМ (р-ХМ), которые поглощаются
- 11. Промежуточный обмен липидов Внутриклеточный липолиз Адипоциты или клетки жировой ткани (подкожный жир, малый и большой сальники
- 12. Механизм активации гормончувствительной ТАГ-липазы адипоцитов * В постабсорбтивном периоде липолиз в ади-поцитах активируется глюкагоном; * При
- 13. * В результате активации аденилатцик-лазы повышается концентрация ц-АМФ, которая активирует протеинкиназу А (ПКА). * ПКА фосфорилирует
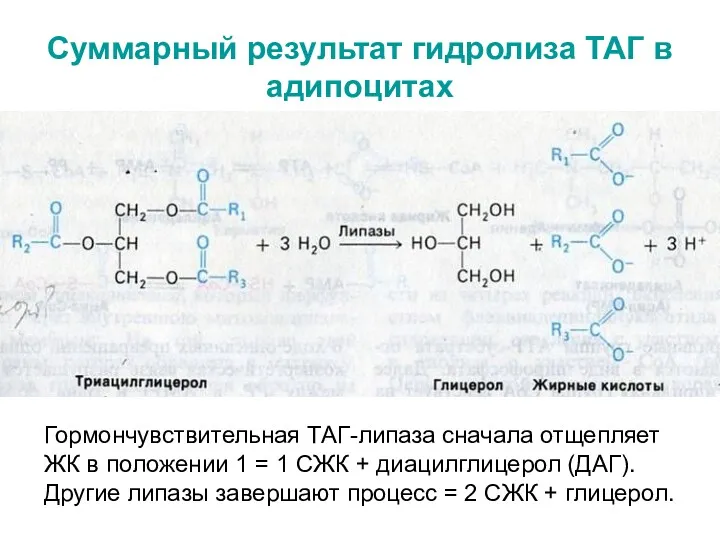
- 14. Суммарный результат гидролиза ТАГ в адипоцитах Гормончувствительная ТАГ-липаза сначала отщепляет ЖК в положении 1 = 1
- 15. * СЖК транспортируются по крови в комплексе с альбумином – молекула альбумина имеет 7 специфических сайтов
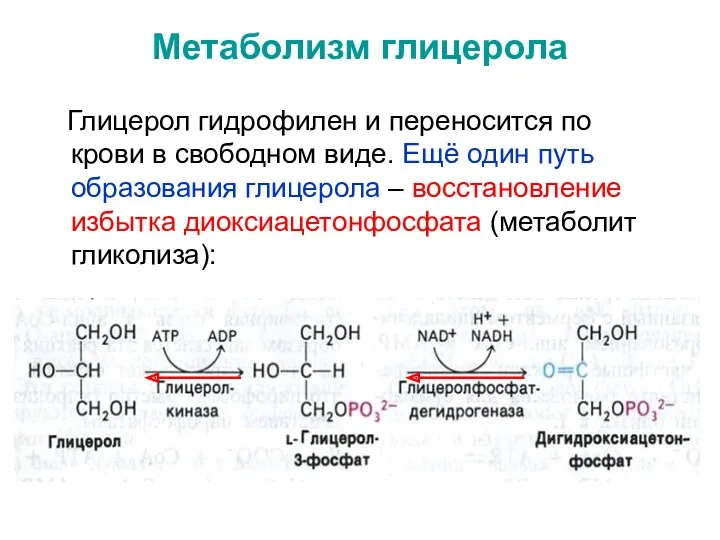
- 16. Метаболизм глицерола Глицерол гидрофилен и переносится по крови в свободном виде. Ещё один путь образования глицерола
- 17. * Глицерол является субстратом для: - липогенеза; - глюконеогенеза или может окисляется через диокси-ацетонфосфат по гликолитическому
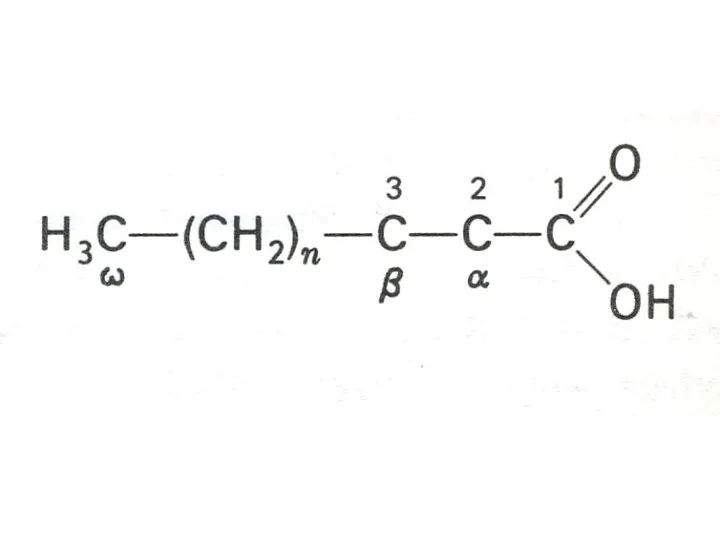
- 18. Окисление жирных кислот Путь окисления СЖК, сопряженный с синте-зом АТФ, протекает в митохондриях [Ю.Кеннеди и А.Ленинджер,
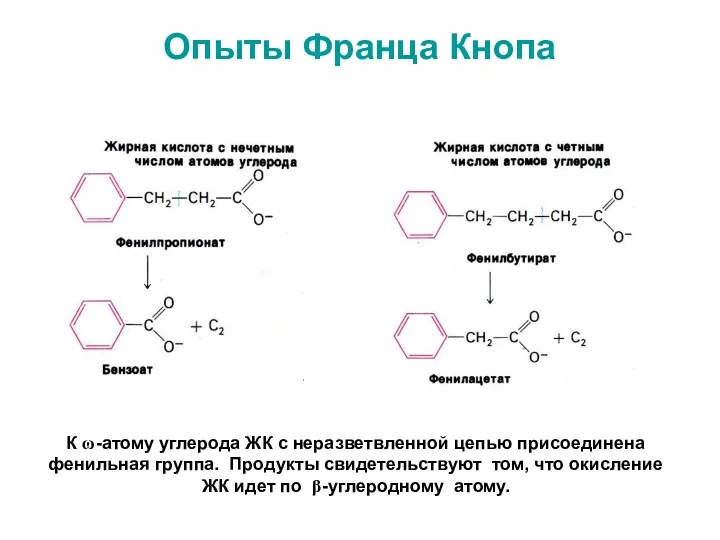
- 20. Опыты Франца Кнопа К ω-атому углерода ЖК с неразветвленной цепью присоединена фенильная группа. Продукты свидетельствуют том,
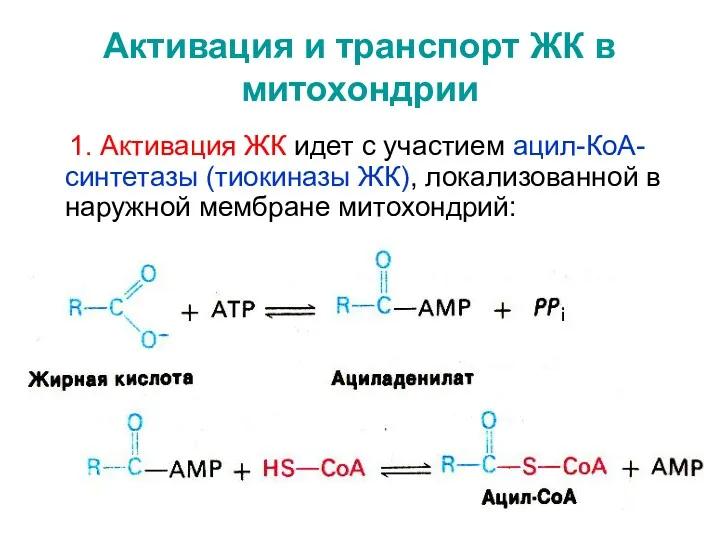
- 21. Активация и транспорт ЖК в митохондрии 1. Активация ЖК идет с участием ацил-КоА-синтетазы (тиокиназы ЖК), локализованной
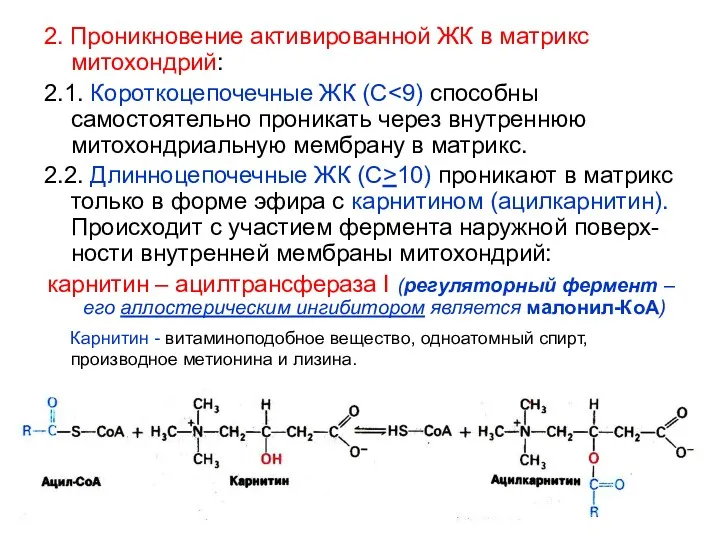
- 22. 2. Проникновение активированной ЖК в матрикс митохондрий: 2.1. Короткоцепочечные ЖК (С 2.2. Длинноцепочечные ЖК (С>10) проникают
- 23. 2.3. Обратное превращение: ацилкарнитин ? ацил-КоА Происходит с участием фермента, локализованном на внутренней поверхности внутренней мембраны
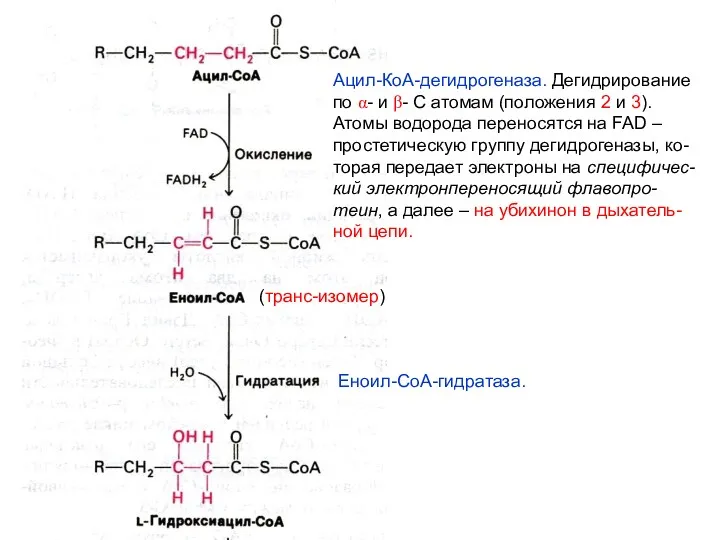
- 24. Реакции β-окисления жирных кислот Путь β-окисления – повторяющаяся последова- тельность четырех реакций. На каждом этапе окисления
- 25. Ацил-КоА-дегидрогеназа. Дегидрирование по α- и β- С атомам (положения 2 и 3). Атомы водорода переносятся на
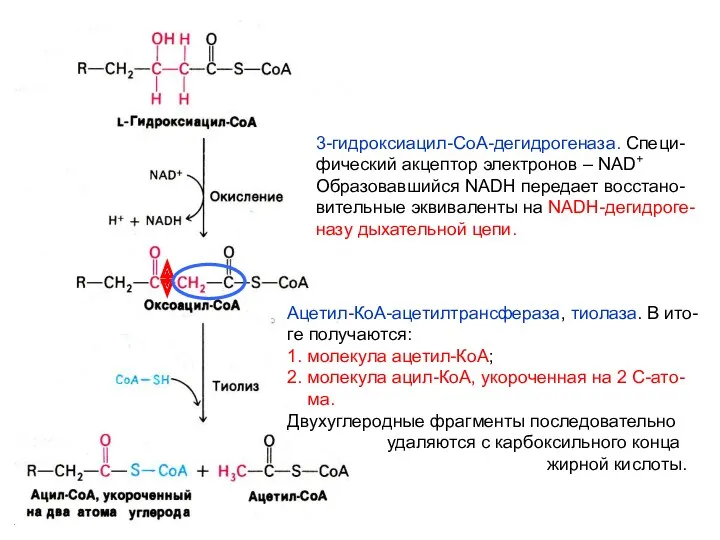
- 26. 3-гидроксиацил-СоА-дегидрогеназа. Специ- фический акцептор электронов – NAD+ Образовавшийся NADH передает восстано- вительные эквиваленты на NADH-дегидроге- назу
- 27. Особенности β-окисления ЖК с нечетным числом С-атомов и ненасыщенных ЖК 1. ЖК с нечетным числом С-атомов
- 28. 2. Ненасыщенные ЖК (содержат двойные связи): Требует участия дополнительных ферментов: 1. Если ЖК имеет 1 двойную
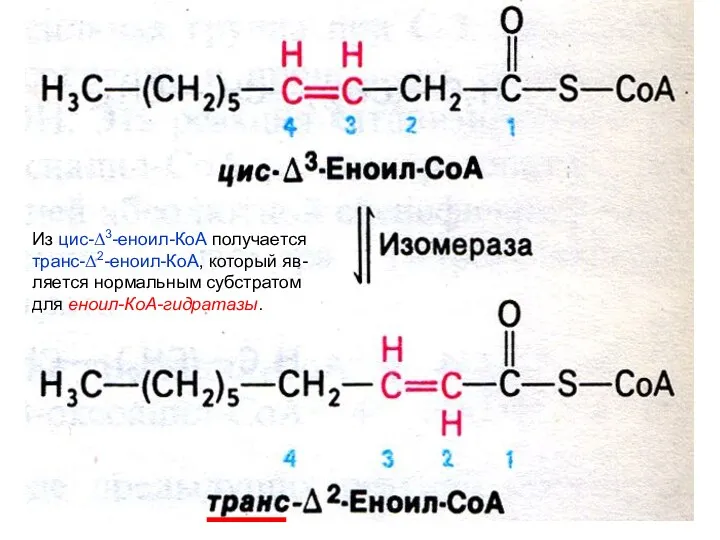
- 29. Из цис-Δ3-еноил-КоА получается транс-Δ2-еноил-КоА, который яв- ляется нормальным субстратом для еноил-КоА-гидратазы.
- 30. 2. Если окисляется ЖК с двумя двойными связями – линолевая к-та (С18:2, цис- Δ9,Δ12) I фермент:
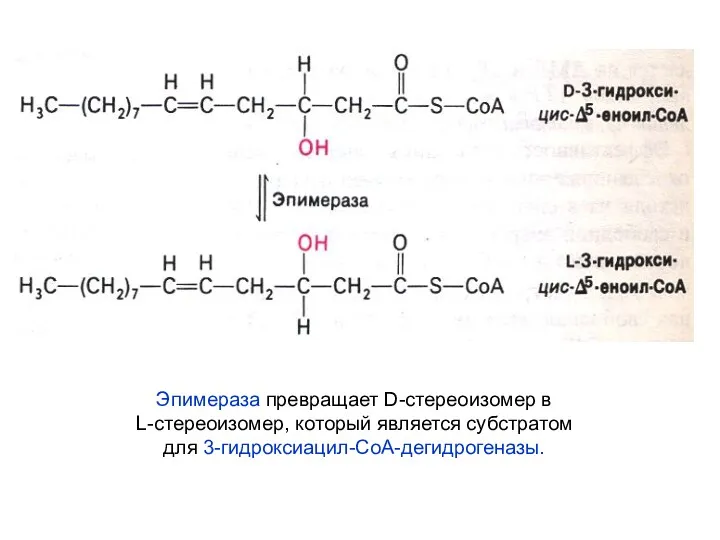
- 31. Эпимераза превращает D-стереоизомер в L-стереоизомер, который является субстратом для 3-гидроксиацил-СоА-дегидрогеназы.
- 32. Выход АТФ при β-окислении пальмитиновой кислоты Каждый этап β–окисления сопровождается образованием ФАДН2 и НАДН. Их реокисление
- 33. КЕТОГЕНЕЗ Избыточное образование ацетил-КоА или снижение его утилизации в ЦТК (причины!) приводит к активации кетогенеза в
- 34. Ацетил-КоА, как продукт окисления ЖК, далее окисляется в ЦТК («Жиры сгорают в пламени углеводов»). В норме,
- 35. При голодании и диабете (окисление ЖК усиливается, а глюкозы – подавляется): Ацетил-КоА образуется в избытке; Концентрация
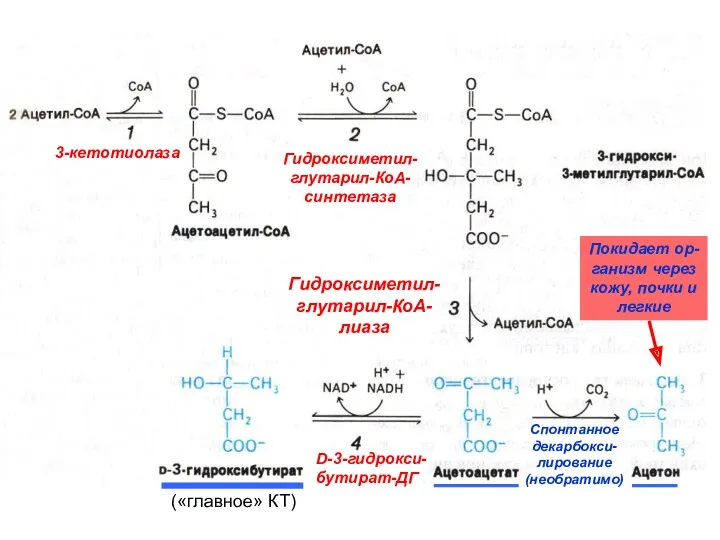
- 36. 3-кетотиолаза Гидроксиметил- глутарил-КоА- синтетаза Гидроксиметил- глутарил-КоА- лиаза D-3-гидрокси- бутират-ДГ Спонтанное декарбокси- лирование (необратимо) («главное» КТ) Покидает
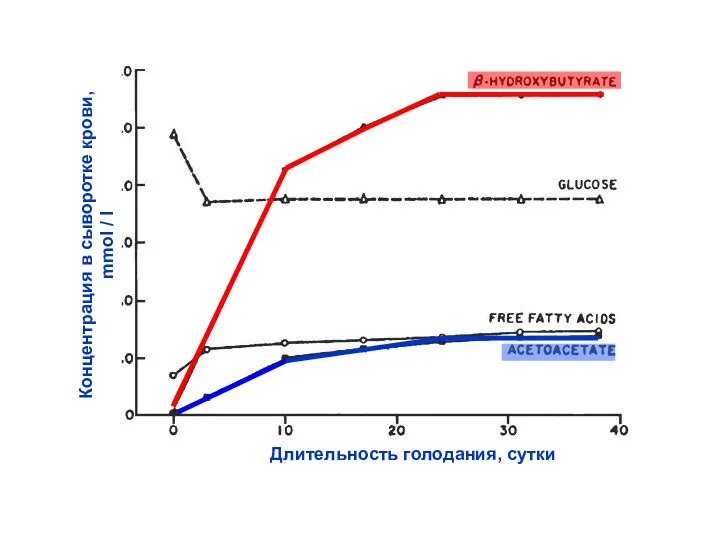
- 37. Длительность голодания, сутки Концентрация в сыворотке крови, mmol / l
- 38. Ацетоацетат и гидроксибутират свободно диф- фундируют (по градиенту концентрации) из гепатоцитов в кровь и доставляются к
- 39. При длительном голодании и при диабете концентрация кетоновых тел в крови может достигать чрезвычайно высоких значений.
- 41. Скачать презентацию






















 Факторы, влияющие на скорость химической реакции
Факторы, влияющие на скорость химической реакции Дисперсные системы: получение и свойства
Дисперсные системы: получение и свойства Приложения II начала термодинамики
Приложения II начала термодинамики Общее понятие о липидах. Переваривание и всасывание липидов
Общее понятие о липидах. Переваривание и всасывание липидов Зеленая химия полиуретанов: механизм, катализ, проблемы использования возобновляемого сырья
Зеленая химия полиуретанов: механизм, катализ, проблемы использования возобновляемого сырья Основные классы неорганических веществ
Основные классы неорганических веществ Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс
Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс Представники d-елементів (перехідних елементів) періодичної системи елементів
Представники d-елементів (перехідних елементів) періодичної системи елементів Полисахаридтер – жоғары молекулалық көмірсулар
Полисахаридтер – жоғары молекулалық көмірсулар Химия и путешествия во времени. Задача 7
Химия и путешествия во времени. Задача 7 Понятие о СМС и моющем процессе
Понятие о СМС и моющем процессе Лабораторная работа Исследование состава молока
Лабораторная работа Исследование состава молока Сопряжение электронной плотности, как фактор обеспечения стабильности молекул
Сопряжение электронной плотности, как фактор обеспечения стабильности молекул Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Topic 3.2
Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Topic 3.2 Строение и свойства металлов Физические и механические свойства металлов
Строение и свойства металлов Физические и механические свойства металлов Скорость химических реакций
Скорость химических реакций Магматические горные породы
Магматические горные породы Химиялық реакция белгілерін атаңыз
Химиялық реакция белгілерін атаңыз Термическая и химико-термическая обработка
Термическая и химико-термическая обработка Аналітична хімія. Лекція 1
Аналітична хімія. Лекція 1 Окислительно-восстановительные реакции в аналитической химии
Окислительно-восстановительные реакции в аналитической химии Кристаллическое состояние веществ
Кристаллическое состояние веществ Мыс купоросы кристалдары
Мыс купоросы кристалдары Электронное строение атома. Занятие 5
Электронное строение атома. Занятие 5 Химические свойства металлов
Химические свойства металлов Химический состав и пищевая ценность продовольственных товаров
Химический состав и пищевая ценность продовольственных товаров Качественный анализ (часть 1)
Качественный анализ (часть 1) Історичні відомості про способи класифікації хімічних елементів. Поняття про лужні метали, галогени, інертні гази
Історичні відомості про способи класифікації хімічних елементів. Поняття про лужні метали, галогени, інертні гази