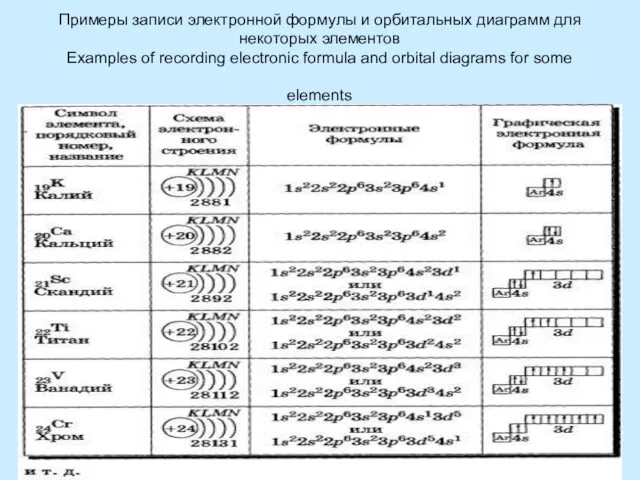
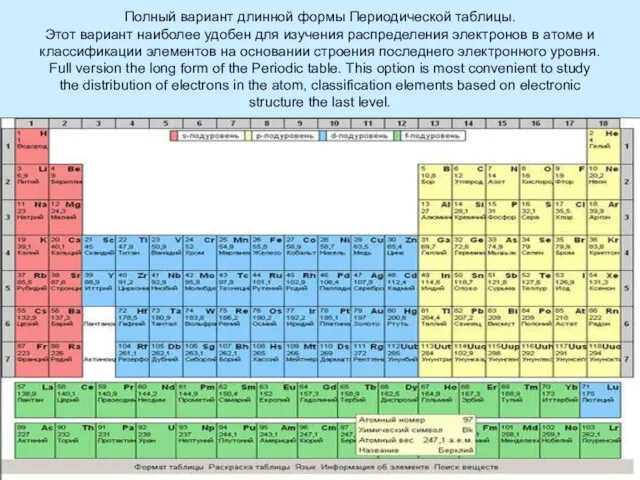
Основные правила заполнения электронами электронных уровней
На одной орбитали не может находится
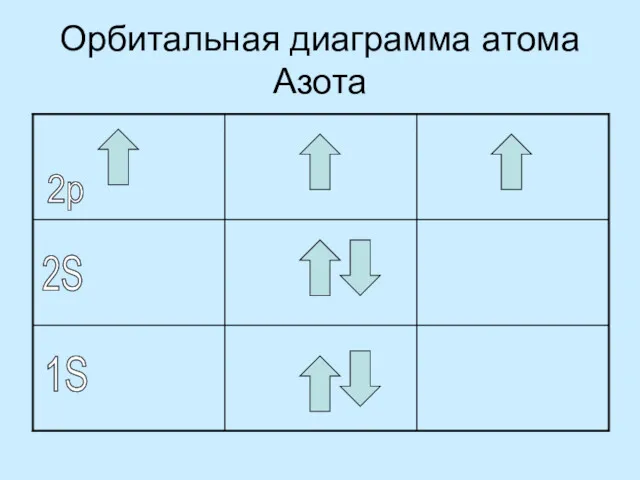
одновременно больше двух электронов (Правило Паули)
Электроны заполняют свои орбитали вначале по одиночке, а только потом образуют пары (Правило Гунда)
Принцип минимума энергии: при заполнении электронных оболочек в первую очередь заполняются оболочки с минимальной энергией (ближайшие к ядру уровни и подуровни)
Правило «октета - дублета»Все атомы стремятся к завершению своего внешнего уровня до двух или восьми электронов.
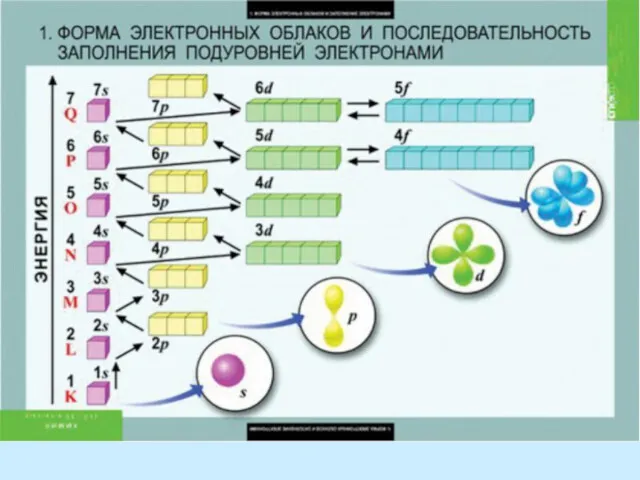
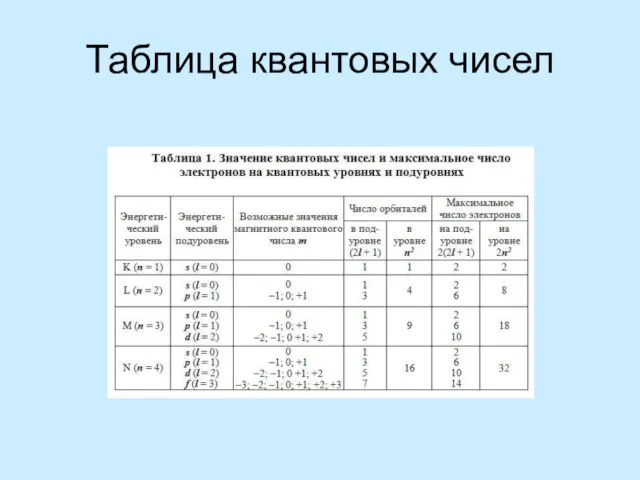
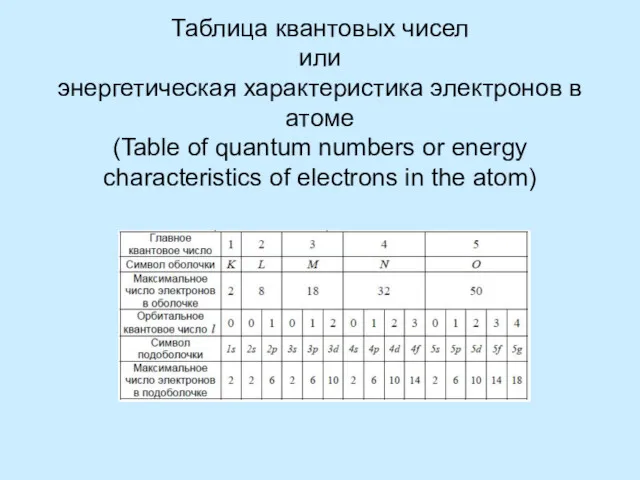
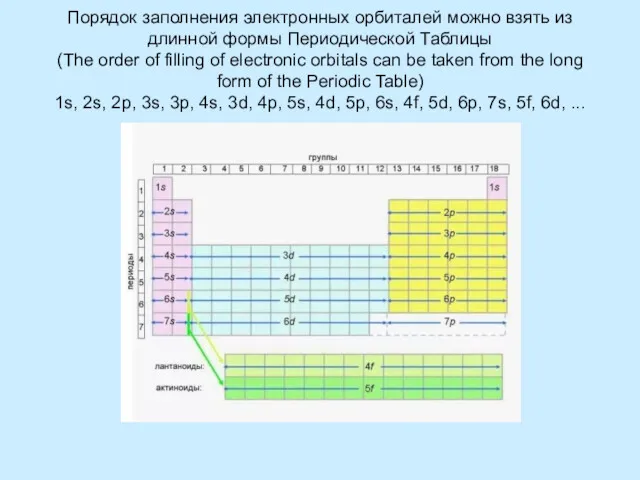
Правило Клечковского – Меделунга. Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главногоПравило Клечковского – Меделунга. Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитальногоПравило Клечковского – Меделунга. Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел . При одинаковой сумме раньше заполняется орбиталь с меньшим значением .
On one orbital is not at the same time more than two electrons (Pauli Rule)
Electrons fill their orbitals in the beginning alone and then form pairs (Rule Gund)
The principle of minimum energy: when filling the electron shells first shell filled with a minimum of energy (closest to nucleus levels and sub-levels)
The rule of "octet - doublet"All the atoms tend to complete their outer level to two or eight electrons.
The Rule Kleczkowska – Madelung. The filling of the electron orbitals in the atom occurs in ascending order of the sum of the main and orbital quantum numbers . For the same amount ahead is filled orbital with a lower value .










 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей