Слайд 2

Химическая кинетика
Химическая кинетика — наука о скоростях и механизмах химических реакций.
Слайд 3

Термодинамика или кинетика?
Быть или не быть?
Когда быть?
Слайд 4

Химическая кинетика решает следующие задачи, перечисленные в порядке сложности их решения:
1.
Установление экспериментальным путем зависимости между скоростью химической реакции и условиями ее проведения, т. е. концентрацией реагентов и продуктов, концентрацией катализатора (если он есть в системе), температурой, давлением и т. д.
2. Установление механизма химической реакции, т. е. выяснение элементарных стадий, из которых она состоит, и идентификация активных промежуточных частиц, ответственных за осуществление этих стадий.
3. Установление связи между строением химических соединений и их реакционной способностью.
В сжатой форме эти три основные задачи химической кинетики можно сформулировать так: изучение химических превращений, предсказание их и управление ими.
Слайд 5

Скорость химической реакции
Скорость химической реакции — это число актов превращения в
единице объема в единицу времени.
Например, для реакции:
νA A + νB B + ... ⎯→ νx X + νy Y + ... ,
где νi — стехиометрические коэффициенты,
Скорость химической реакции будет описываться уравнением, если i-е вещество исходное:
Если j-е вещество — продукт реакции:
(V = const , Ci — концентрация вещества i)
Слайд 6

Кинетическое уравнение
Кинетическое уравнение — это уравнение, описывающее зависимость скорости химической реакции
от концентраций компонентов реакционной смеси.
Слайд 7

Слайд 8

Слайд 9
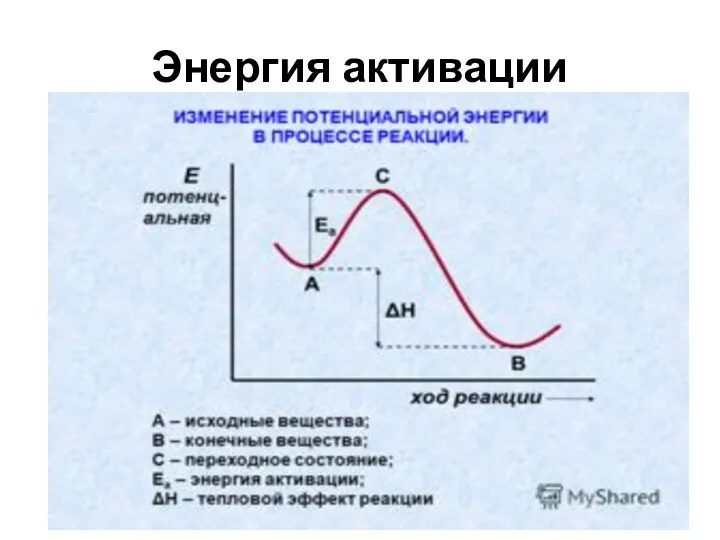
Слайд 10

Слайд 11

Формальная кинетика
Формальная кинетика — это раздел кинетики, рассматривающий временной ход превращений
вне связи с конкретной природой объектов, участвующих в превращении. Для формальной кинетики важна лишь математическая форма уравнений, описывающих кинетику превращения, но не детальная природа превращения. Например, формальная кинетика одинакова для двух таких разных процессов, как распад или изомеризация молекул (это — химические процессы) и радиоактивный распад атомных ядер (это — физический процесс).
Слайд 12

Закон действующих масс
Кинетический закон действующих масс был сформулирован в шестидесятые годы
XIX в. Тогда его формулировали так: скорость химической реакции пропорциональна концентрации взаимодействующих частиц.
Сегодня ясно, что в такой формулировке закон действующих масс справедлив только для простых реакций, т. е. он формулируется так: скорость простой химической реакции пропорциональна концентрации взаимодействующих частиц.
Слайд 13













 Химические формулы
Химические формулы Удивительные свойства воды
Удивительные свойства воды Графен. Свойства и получение. Функционализация и применение композитов на его основе
Графен. Свойства и получение. Функционализация и применение композитов на его основе Значення хімії у повсякденному житті
Значення хімії у повсякденному житті Конструкционные функциональные волокнистые композиты. Стеклопластики
Конструкционные функциональные волокнистые композиты. Стеклопластики Характеристика элементов VI группы .Кислород. Озон
Характеристика элементов VI группы .Кислород. Озон Химический состав водоотталкивающих средств
Химический состав водоотталкивающих средств Процессы нитрозирования и основные реакции диазосоединений
Процессы нитрозирования и основные реакции диазосоединений Благородные газы
Благородные газы Алюминий и его свойства
Алюминий и его свойства Химические реакторы. Лекция №10
Химические реакторы. Лекция №10 Классификация химических реакций
Классификация химических реакций Жесткость воды и способы её устранения
Жесткость воды и способы её устранения Галогени. Хімічні властивості
Галогени. Хімічні властивості Вода
Вода Классификация химических реакций (11 класс)
Классификация химических реакций (11 класс) Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Iron Oxide
Iron Oxide Electrochemistry
Electrochemistry Теория электролитической диссоциации
Теория электролитической диссоциации Газовые смеси
Газовые смеси Оксид меди
Оксид меди Кислоты. Определение и классификация
Кислоты. Определение и классификация Решение задачи №4. Старость - на радость. Команда Карбораны
Решение задачи №4. Старость - на радость. Команда Карбораны Элементы IV группы главной подгруппы. Углерод
Элементы IV группы главной подгруппы. Углерод Альтернативная елочка из кристаллов
Альтернативная елочка из кристаллов Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс
Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс Кислые породы повышенной щелочности и щелочные
Кислые породы повышенной щелочности и щелочные