ВОПРОС 3. СЕРЕБРО И ЗОЛОТО: РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПОЛУЧЕНИЕ, ФИЗИЧЕСКИЕ И
ХИМИЧЕСКИЕ СВОЙСТВА
В природе серебро встречается в самородном виде и в виде соединений: Ag3SbS3 – пираргит; Ag3AsS3 – прустит; Ag2S – серебряный блеск. Золото встречается только в самородном виде. Серебро получают при переработке сернистых руд цинка, свинца и меди, а также выщелачиванием цианидами щелочных металлов:
AgCl + 2KCN = K[Ag(CN)2] + KCl;
Ag2S + 4KCN = 2K[Ag(CN)2] + K2S.
Затем серебро восстанавливают порошком цинка:
2Zn + 2K[Ag(CN)2] = 2Ag + K2[Zn(CN)4].
Золото получают промывкой измельченной горной золотосодержащей породы. Затем породу промывают 0,1 – 2% раствором цианида калия или натрия:
4Au + O2 + 8KCN +2H2O = 4K[Au(CN)2] + 4KOH,
а затем восстанавливают золото цинком:
Zn + 2K[Au(CN)2] = 2Au + K2[Zn(CN)4].











 Р-элементы IV Группы Периодической Системы
Р-элементы IV Группы Периодической Системы Титан. Хром
Титан. Хром 20230330_metodicheskaya_razrabotka_ovr_v_organicheskoy_himii
20230330_metodicheskaya_razrabotka_ovr_v_organicheskoy_himii Сульфаттау және сульфирлеу процестері Сульфохлорлау арқылы алкилсульфонаттарды алу
Сульфаттау және сульфирлеу процестері Сульфохлорлау арқылы алкилсульфонаттарды алу Алкены. Гомологический ряд и изомерия
Алкены. Гомологический ряд и изомерия Органические производные титана со связью Ti-C
Органические производные титана со связью Ti-C Композиционные материалы
Композиционные материалы Коллоидная химия
Коллоидная химия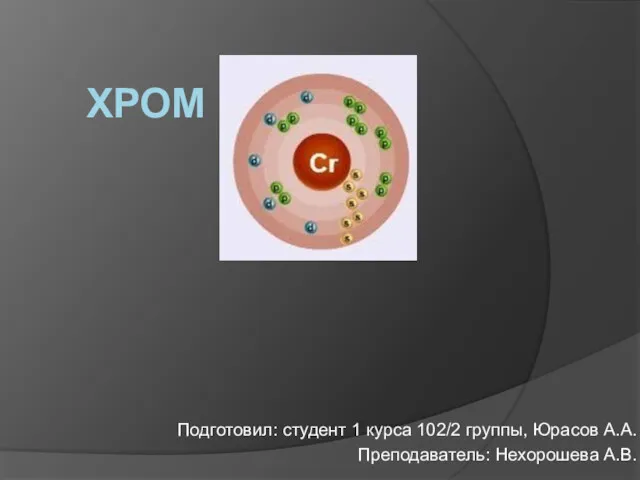 Хром. Хром в организме человека
Хром. Хром в организме человека Нанохимия
Нанохимия Атом құрылысы Сu. Биологиялық маңызы
Атом құрылысы Сu. Биологиялық маңызы Галогены. Их роль в нашей жизни
Галогены. Их роль в нашей жизни Азот. Соединения азота
Азот. Соединения азота Качественные реакции. Анионы
Качественные реакции. Анионы Способы выражения состава растворов
Способы выражения состава растворов Водород - топливо будущего
Водород - топливо будущего Платина. Физические и химические свойства
Платина. Физические и химические свойства Закон Авогадро. Молярный объём газов
Закон Авогадро. Молярный объём газов Галогены (солеобразующие)
Галогены (солеобразующие) Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Загрязнение продуктов питания
Загрязнение продуктов питания Типы химических реакций на примере свойств воды
Типы химических реакций на примере свойств воды Моющие средства
Моющие средства Катализ и катализаторы. (Лекция 10)
Катализ и катализаторы. (Лекция 10) Спирты
Спирты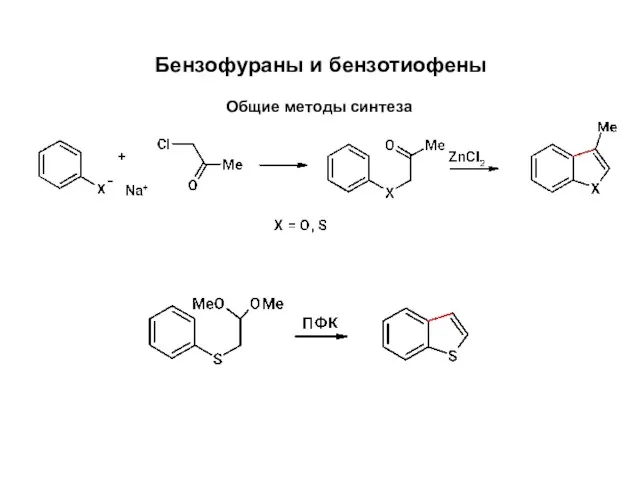 Бензофураны и бензотиофены. Общие методы синтеза
Бензофураны и бензотиофены. Общие методы синтеза Обед под микроскопом. Минеральные вещества
Обед под микроскопом. Минеральные вещества