Содержание
- 2. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Раздел химии, изучающий механизмы химических реакций и скорости их протекания, называется химической кинетикой.
- 3. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Гетерогенные реакции характеризуются наличием поверхности раздела фаз, где протекает взаимодействие субстрата и реагента.
- 4. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Скорость химической реакции определяется изменением концентрации реагирующих веществ в единицу времени: Если измерять
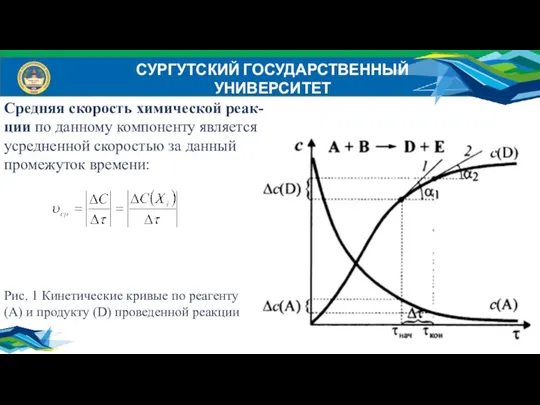
- 5. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Средняя скорость химической реак- ции по данному компоненту является усредненной скоростью за данный
- 6. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Истинная скорость химической реакции характеризуется ее скорость в данный промежуток времени : Средняя
- 7. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Механизм – это путь, т.е. последовательность элементарных актов взаимодействия реагентов, через которые протекает
- 8. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Сложные реакции – это реакции, протекающие в несколько стадий, каждая из которых является
- 9. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Стадии сложных реакций могут протекать: последовательно друг за другом: параллельно: последовательно-параллельно: циклически:
- 10. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ ГОМОГЕННОЙ РЕАКЦИИ 1. Природа реагирующих веществ; 2. Концентрация реагентов;
- 11. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ВЛИЯНИЕ ПРИРОДЫ РЕАГИРУЮЩИХ ВЕЩЕСТВ В зависимости от природы реагентов, скорость реакции будет меняться:
- 12. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ВЛИЯНИЕ КОНЦЕНТРАЦИИ РЕАГЕНТОВ Закон действующих масс: скорость простой гомогенной реакции при постоянной температуре
- 13. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Кинетическое уравнение химической гетерогенной реакции : имеет вид: - константа скорости реакции; -
- 14. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Константа скорости реакции I порядка если моль/л а - исходная концентрация субстрата; (а-х)
- 15. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Тогда, В состоянии равновесия: т.е.
- 16. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Интегрируем с разделением переменных: Получаем выражение: где J – постоянная интегрирования; при х=0
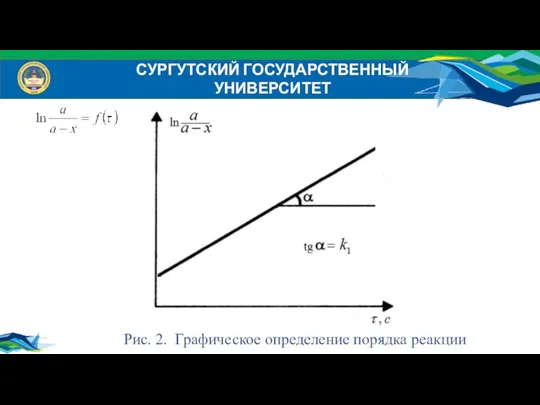
- 17. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Преобразуем: Выразим константу скорости реакции: Проверить правильность анализа можно графическим либо аналитическим методом.
- 18. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Рис. 2. Графическое определение порядка реакции
- 19. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Для анализа удобно пользоваться полупериодом реакции, т.е. когда прореагировало 0,5 субстрата. Тогда, т.е.
- 20. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Константа скорости реакции II порядка а - исходная концентрация субстрата; (а-х) – текущая
- 21. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Тогда, В состоянии равновесия: т.е.
- 22. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Интегрируем с разделением переменных: Получаем выражение: где J – постоянная интегрирования при х=0
- 23. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Преобразуем: Выразим константу скорости реакции: Проверить правильность анализа можно графическим либо аналитическим методом.
- 24. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Строят график зависимости и по углу наклона определяют константу скорости реакции второго порядка
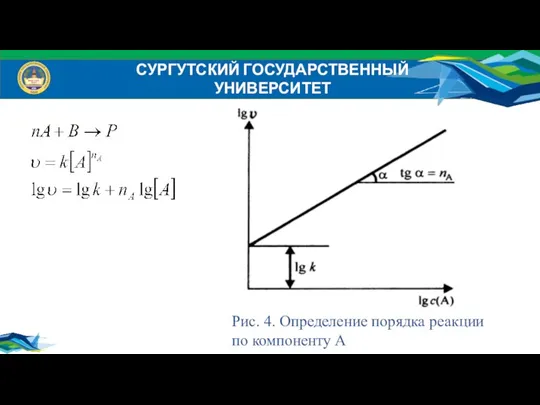
- 25. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Порядок реакции по реагенту равен показателю степени, в которую надо возвести концентрацию данного
- 26. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Рис. 4. Определение порядка реакции по компоненту А
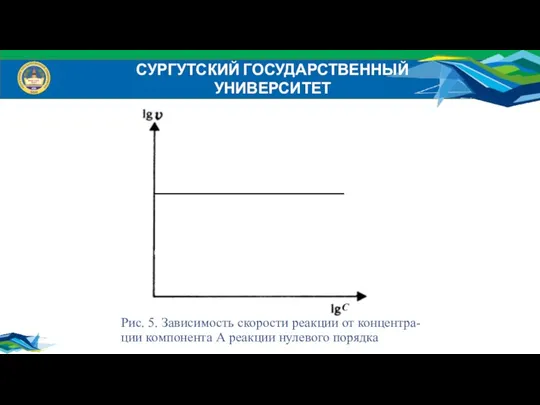
- 27. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Рис. 5. Зависимость скорости реакции от концентра- ции компонента А реакции нулевого порядка
- 28. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ 2. Метод подстановки в формулы Заключается в том, что опытные результаты (текущие концентрации
- 29. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Молекулярность реакции определяет число молекул, участвующих в элементарном акте взаимодействия. Молекулярность часто не
- 30. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Например: - для третичных галоген производных углеводородов:
- 31. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Например: - для первичных галоген производных углеводородов:
- 32. Количественные закономерности константы скорости реакции от температуры константа скорости реакции; экспонента; предэкспоненциальный множитель, равный числу соударений
- 33. Число активных соударений представляет собой энтропийный фактор: Тогда получаем уравнение Вант-Гоффа: СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
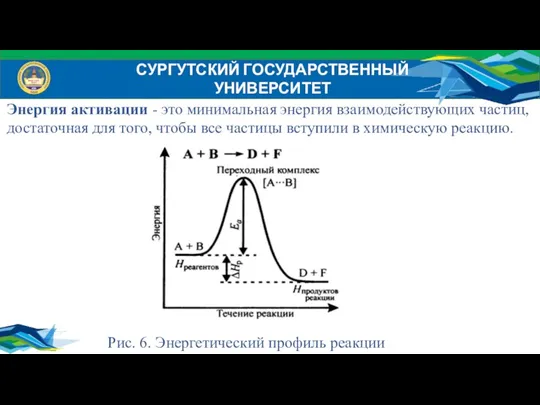
- 34. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Энергия активации - это минимальная энергия взаимодействующих частиц, достаточная для того, чтобы все
- 35. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Энергия активации является очень важной энергетической характеристикой реакции, которая связана с константой скорости
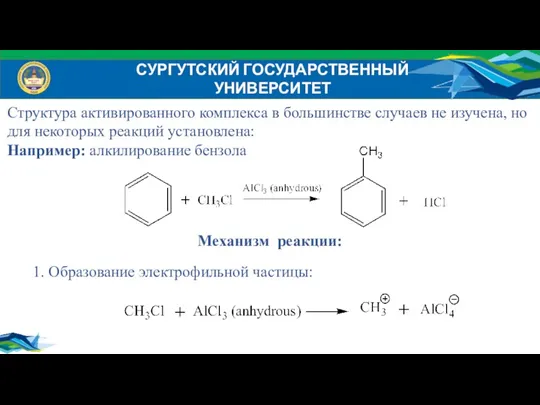
- 36. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Структура активированного комплекса в большинстве случаев не изучена, но для некоторых реакций установлена:
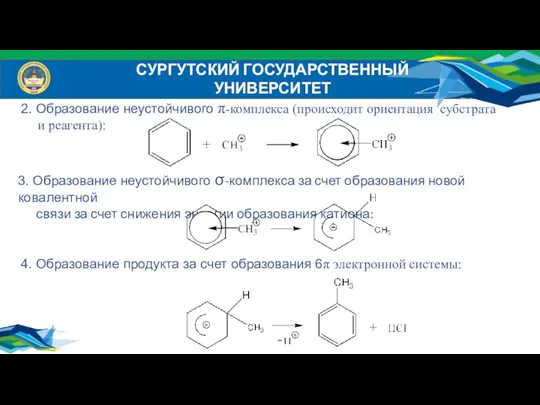
- 37. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ 4. Образование продукта за счет образования 6π электронной системы: 3. Образование неустойчивого σ-комплекса
- 38. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Значение энергии активации реакции можно определить, измерив константы скорости этой реакции при двух
- 39. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Энергия активации - это минимальная энергия взаимодействующих частиц, достаточная для того, чтобы все
- 40. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ РЕАКЦИИ Уравнение Вант-Гоффа: с увеличением температуры на каждые 10°С
- 41. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Теория активных столкновений Не каждое столкновение приводит к акту химического взаимодействия; К химическому
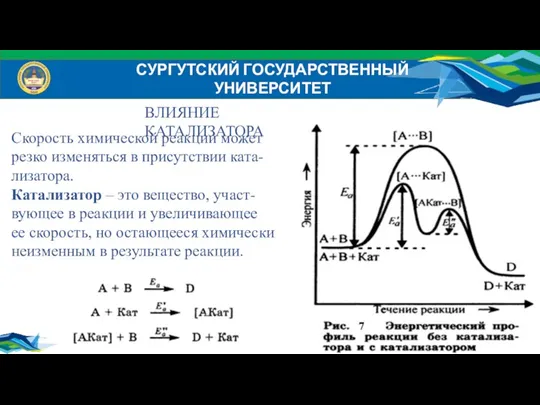
- 42. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ВЛИЯНИЕ КАТАЛИЗАТОРА Скорость химической реакции может резко изменяться в присутствии ката- лизатора. Катализатор
- 43. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ХИМИЧЕСКОЕ РАВНОВЕСИЕ Химические реакции бывают необратимые и обратимые: Необратимые химические реакции – это
- 44. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Обратимые – это реакции, в которых одновременно протекают две взаимно противоположные реакции –
- 45. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Химическое равновесие – это такое состояние обратимого процесса, при котором скорости прямой и
- 46. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Особенности состояния химического равновесия Динамический характер химического равновесия – прямая и обратная реакции
- 47. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Выведем, чему равна константа равновесия процесса, протекающего в гомогенной системе: В состоянии химического
- 48. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Константа химического равновесия обратимого процесса равна отношению произведения равновесных концентраций продуктов реакции к
- 49. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Смещение химического равновесия Влияние температуры; Концентрации веществ; Давления (в системах газообразных веществ); Влияние
- 50. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Влияние концентрации реагентов на смещение химического равновесия
- 51. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Влияние давления реагентов на смещение химического равновесия
- 52. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Влияние температуры на состояние химического равновесия:
- 53. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Влияние катализатора Катализатор не вызывает смещения химического равновесия, а лишь ускоряет его наступление
- 54. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Принцип адаптивных перестроек Любая живая система при воздействии на нее перестраивается так, чтобы
- 56. Скачать презентацию













































 Химическая связь
Химическая связь Характеристика элемента по его положению в периодической системе химических элементов (1)
Характеристика элемента по его положению в периодической системе химических элементов (1) Взаємодія води з кислотними оксидами
Взаємодія води з кислотними оксидами Механические свойства минералов
Механические свойства минералов Свойства кислорода. Получение кислорода методом вытеснения воздуха
Свойства кислорода. Получение кислорода методом вытеснения воздуха Волшебница - вода
Волшебница - вода Свойства концентрированной азотной кислоты
Свойства концентрированной азотной кислоты Углерод. Аллотропные модификации
Углерод. Аллотропные модификации Комплексные соединения
Комплексные соединения Химическое равновесие. Необратимые и обратимые реакции
Химическое равновесие. Необратимые и обратимые реакции Энергетический обмен
Энергетический обмен АТФ молекуласының құрылысы мен қызметтері
АТФ молекуласының құрылысы мен қызметтері Склад і основні фізико-хімічні властивості молочного білку
Склад і основні фізико-хімічні властивості молочного білку Минералы свинца
Минералы свинца Көміртек оксидтері
Көміртек оксидтері Оценка опасности взрыва горючих газов
Оценка опасности взрыва горючих газов Роль М. В. Ломоносова и Дж. Дальтона в создании атомно-молекулярного учения
Роль М. В. Ломоносова и Дж. Дальтона в создании атомно-молекулярного учения Основания. Классификация оснований
Основания. Классификация оснований Тайна мыльного пузыря
Тайна мыльного пузыря Кислоты. Классификация кислот
Кислоты. Классификация кислот Технологии создания и обработки кристаллических материалов
Технологии создания и обработки кристаллических материалов Алкины
Алкины Химический элемент. Изотопы. 11 класс
Химический элемент. Изотопы. 11 класс Многоядерные ароматические углеводороды
Многоядерные ароматические углеводороды История открытия периодической системы химических элементов Д.И. Менделеева
История открытия периодической системы химических элементов Д.И. Менделеева Строение атома и периодический закон Д.И. Менделеева
Строение атома и периодический закон Д.И. Менделеева Роль ферментов в формировании потребительских свойств продовольственных товаров
Роль ферментов в формировании потребительских свойств продовольственных товаров Хром. Элемент VI группы побочной подгруппы
Хром. Элемент VI группы побочной подгруппы