Содержание
- 2. Ткань – это филогенетически сложившаяся система обладающих общностью строения (а в ряде случаев и общностью происхождения)
- 3. В любой системе все её элементы упорядочены в пространстве и функционируют согласованно друг с другом. Система
- 4. Морфофункциональная классификация тканей 2. Ткани внутренней среды 3. Мышечные 1. Эпителиальные 4. Нервная
- 5. ОБЩАЯ ХАРАКТЕРИСТИКА, КЛАССИФИКАЦИЯ И МОРФО-ФУНКЦИОНАЛЬНОЕ СТРОЕНИЕ СОЕДИНИТЕЛЬНОЙ ТКАНИ.
- 6. Ткани внутренней среды (соединительные ткани, кровь и лимфа) развиваются из эмбриональной сое-динительной ткани — мезенхимы, участвуют
- 7. Классификация соединительных тканей Собственно соединительная (волокнистая) ткань: рыхлая волокнистая плотная неоформленная плотная оформленная 2. Соединительные ткани
- 8. ОСНОВНЫЕ ФУНКЦИИ СОЕДИНИТЕЛЬНОЙ ТКАНИ.
- 9. Трофическая функция – регуляция питания различных тканевых структур с участием в обмене веществ и поддержании гомеостаза.
- 10. Защитная функция – защита от механических воздействий и обезвреживание чужеродных веществ, поступающих извне или образующихся внутри
- 11. Морфогенетическая функция (структурообразовательная) –формирование тканевых комп-лексов и обеспечение общей структурной организации органов (образование капсул, внутриорган-ных перегородок);
- 12. Опорная функция (биомеханическая) обеспечивается коллагеновыми и эластическими волокнами, образующими волокнистые основы всех органов, а также составом
- 13. Пластическая функция выражается в адаптации к меняющимся условиям существования, способности к регенерации, участии в замещении дефектов
- 14. Главные компоненты соединительных тканей 1. Клетки, создающие и поддер-живающие количественное и качес-твенное соотношение неклеточ- ных компонентов:
- 15. Рыхлая волокнистая ткань: Основные типы клеток: Фибробласты – синтез коллагена, эластина; протеогликанов и глико-протеинов; могут перемещаться
- 16. Рыхлая волокнистая ткань: Внеклеточное вещество: 1. Волокна (коллаген, эластин) 2. Белки клеточной адгезии (фибронектин, ламинин) 3.
- 17. МЕТАБОЛИЗМ КОЛЛАГЕНА И ЭЛАСТИНА.
- 18. Основные структурные белки соединительных тканей – КОЛЛАГЕНЫ (составляют 25% всех белков организма человека) Главная функция −
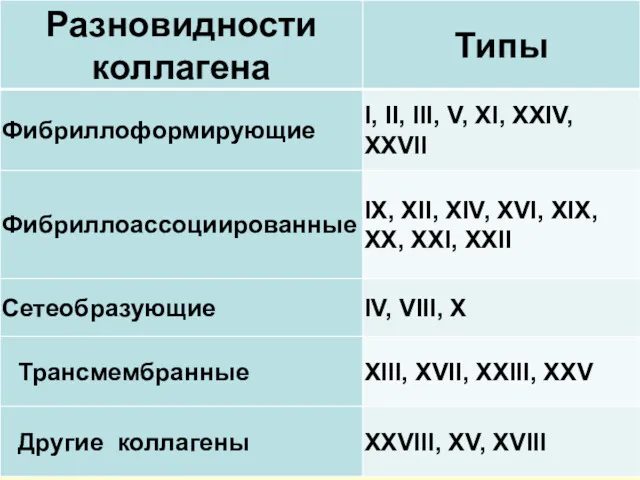
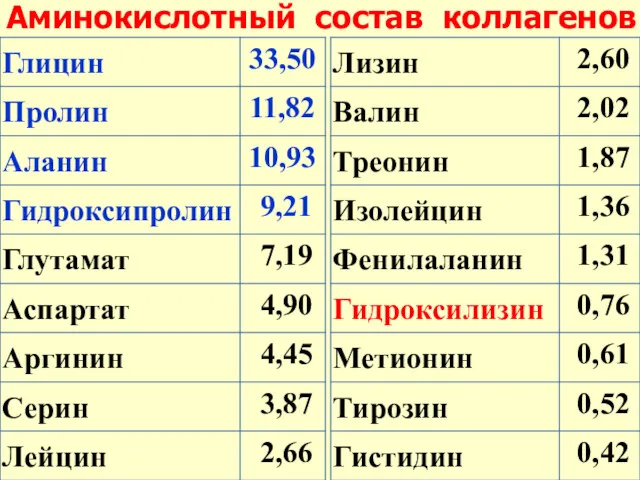
- 20. Аминокислотный состав коллагенов
- 21. Особенность строения коллагена – высокое содержание глицина (33 %!), пролина и гидроксипролина (триплет – глицин-пролин-Х)
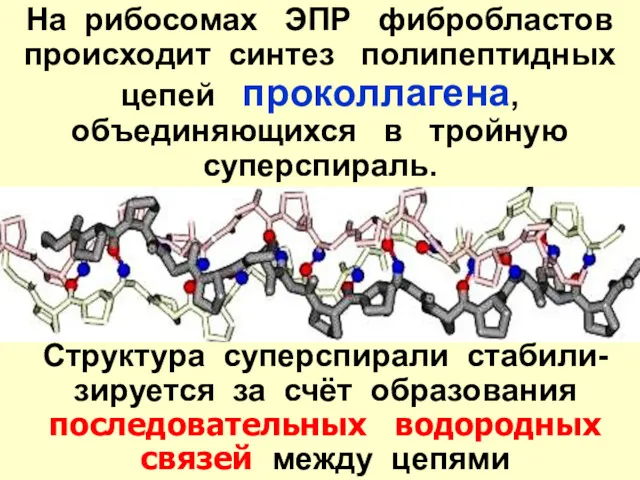
- 22. На рибосомах ЭПР фибробластов происходит синтез полипептидных цепей проколлагена, объединяющихся в тройную суперспираль. Структура суперспирали стабили-зируется
- 23. Синтез и внутриклеточный процессинг коллагена Синтез про-α-цепей на рибо-сомах ЭПР 2. Гидроксилирование в цепях пролина и
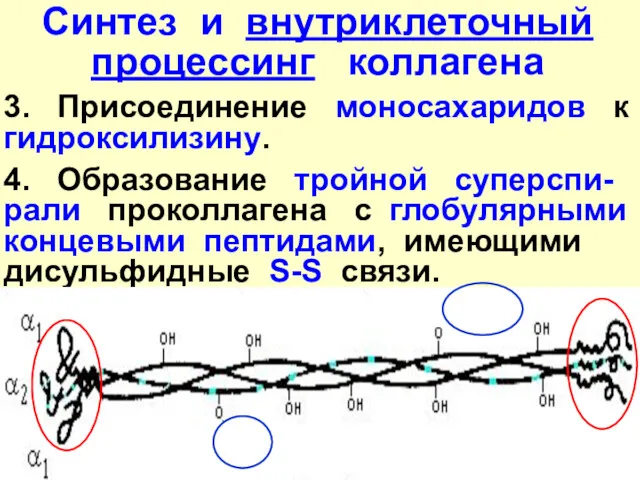
- 24. Синтез и внутриклеточный процессинг коллагена 3. Присоединение моносахаридов к гидроксилизину. 4. Образование тройной суперспи-рали проколлагена с
- 25. Дополнительные аминокислотные последовательности на концах цепей с большим количеством внутри- и межцепочечных дисульфидных (S-S) связей препятствуют
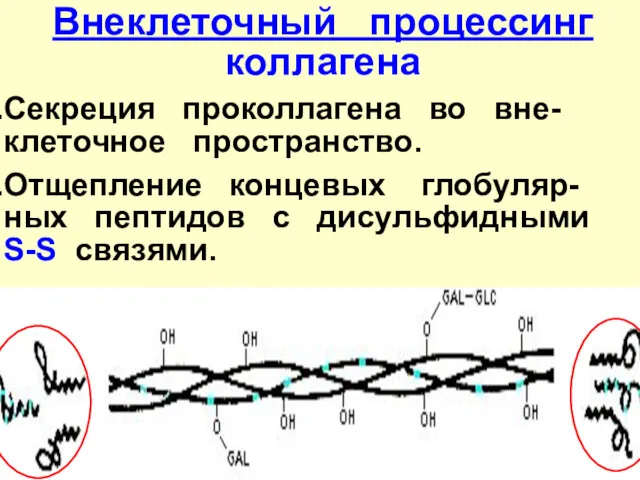
- 26. Внеклеточный процессинг коллагена Секреция проколлагена во вне-клеточное пространство. Отщепление концевых глобуляр-ных пептидов с дисульфидными S-S связями.
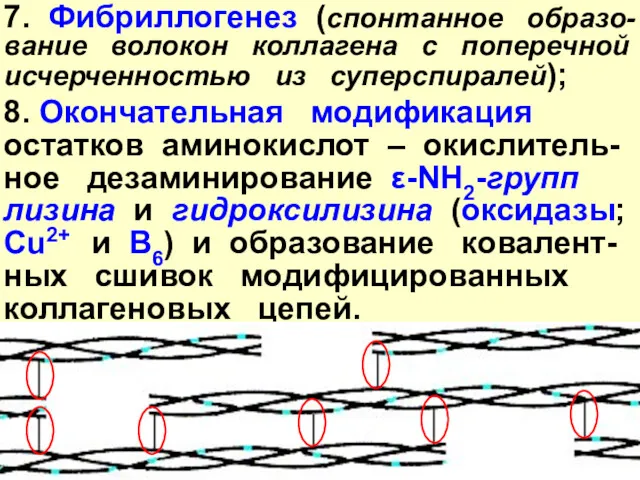
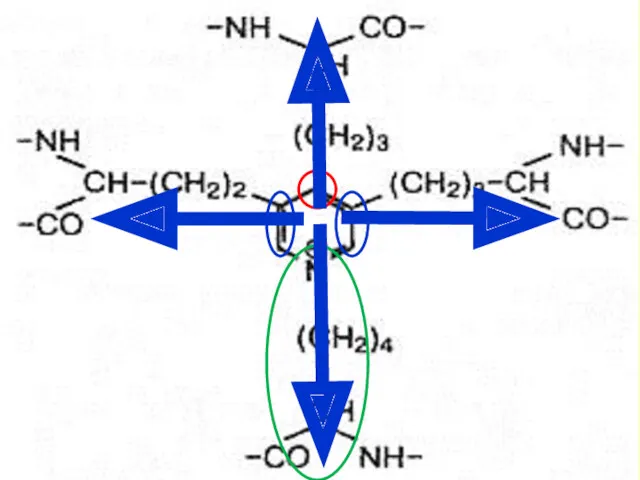
- 27. 7. Фибриллогенез (спонтанное образо-вание волокон коллагена с поперечной исчерченностью из суперспиралей); 8. Окончательная модификация остатков аминокислот
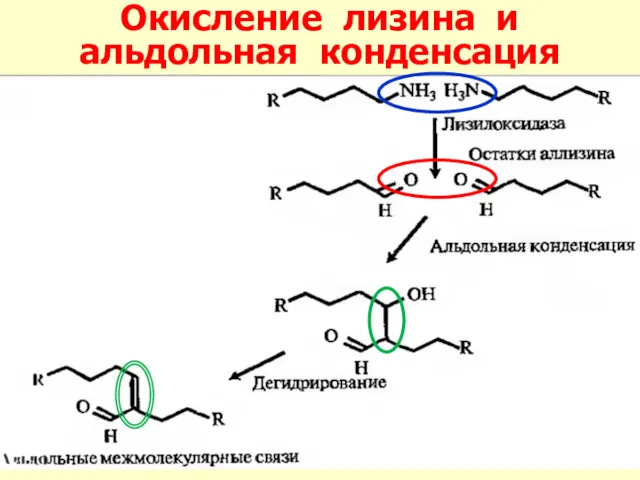
- 28. Окисление лизина и альдольная конденсация
- 29. Особенности эластических волокон Эти волокна придают эластичность внеклеточной матрице. Основной их компонент – эластин (составляет 50%
- 30. Особенности эластических волокон Путём модификаций лизина (остатки которого, объединяясь, превращаются в десмозин или изодесмозин) отдельные молекулы
- 31. Особенности строения и метаболизма углеводных компонентов различных белково-углеводных комплексов внеклеточного матрикса соединительных тканей
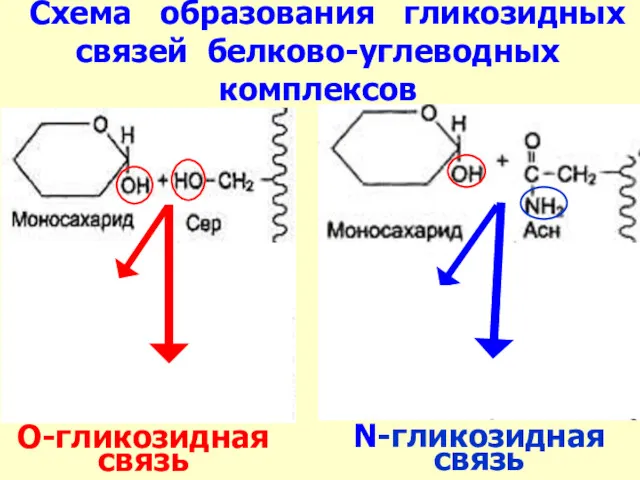
- 33. (белковые цепи – полирибосомы шереховатого ЭПР; углеводные компоненты – комплекс Гольджи) А) О-гликозидные комплексы – последовательное
- 34. Схема образования гликозидных связей белково-углеводных комплексов N-гликозидная связь О-гликозидная связь
- 35. ФУНКЦИИ ГЛИКО-(МУКО)ПРОТЕИНОВ структурные компоненты мем-бран клеток, коллагеновых, элас-тиновых, фибриновых волокон, костного матрикса транспортные молекулы вита-минов, липидов,
- 36. ФУНКЦИИ ГЛИКО-(МУКО)ПРОТЕИНОВ ферментативная активность (факторы свертывания крови) уменьшение трения соприка-сающихся суставных поверхно-стей обеспение групповой, видо-вой и
- 37. ГЛИКО-(МУКО-)ПРОТЕИНЫ содержат моносахариды: глюкозу, галактозу, маннозу, фукозу, гексозамины, а также нейраминовую и сиаловые кислоты. Нет уроновых
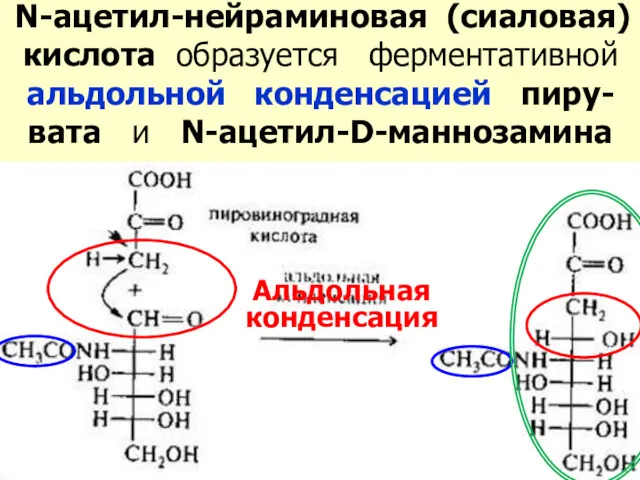
- 38. N-ацетил-нейраминовая (сиаловая) кислота образуется ферментативной альдольной конденсацией пиру-вата и N-ацетил-D-маннозамина Альдольная конденсация
- 39. Сиаловые кислоты входят в состав различных углеводсодержащих веществ (гликопротеины, гликолипиды, в ликворе – в свободном виде
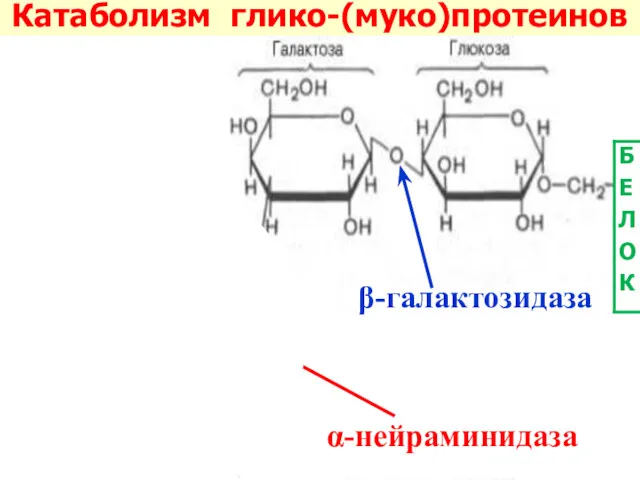
- 40. α-нейраминидаза β-галактозидаза Катаболизм глико-(муко)протеинов
- 41. Сиаловые кислоты значительно влияют на физико-химические свойства и биологическую активность веществ (определяют длительность циркуляции эритроцитов, лимфоцитов,
- 42. Распад белково-углеводных комплексов катализируется большим набором лизосомальных гидролаз: белковая часть – катепсины углеводная часть – гликозидазы
- 43. Протеогликаны — это белково-углеводные комплексы, в которых с молекулами белка ковалентно связаны гетерополисахариды – гликозаминогликаны. Белки
- 44. ФУНКЦИИ ПРОТЕОГЛИКАНОВ универсальные компоненты базальных мембран обеспечение тургора тканей, противодействие силам компрес-сии влияние на расположение рецепторов
- 45. Углеводные компоненты протеогликанов — ГЛИКОЗАМИНОГЛИКАНЫ — это гетерополисахариды, состоящие из многократно повторяющихся дисахаридов, соединенных β(1-4) гликозидными
- 46. Гликозаминогликаны классифицируют: по остаткам моносахаридов, образующих их структурные дисахаридные мономеры; по типу связи между дисаха-ридными мономерами;
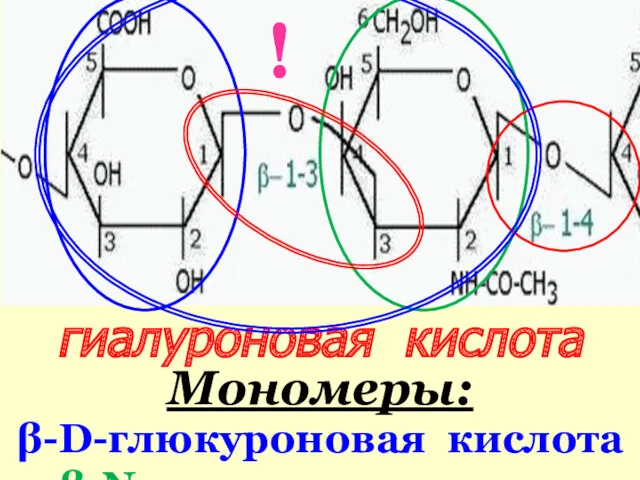
- 47. гиалуроновая кислота Мономеры: β-D-глюкуроновая кислота β-N-ацетилглюкозамин !
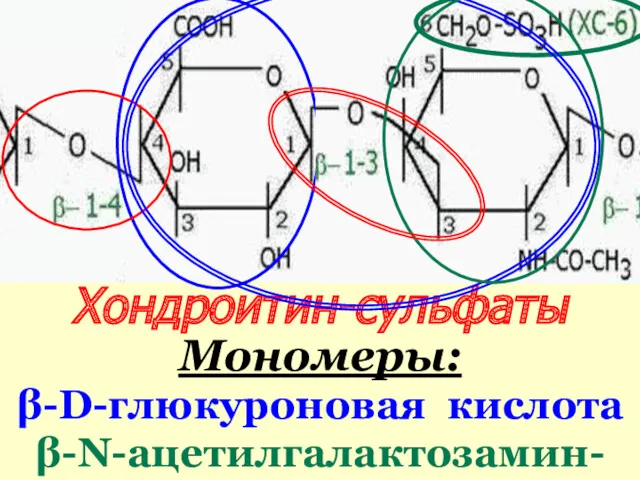
- 48. Хондроитин-сульфаты Мономеры: β-D-глюкуроновая кислота β-N-ацетилгалактозамин-сульфаты (4- или 6-)
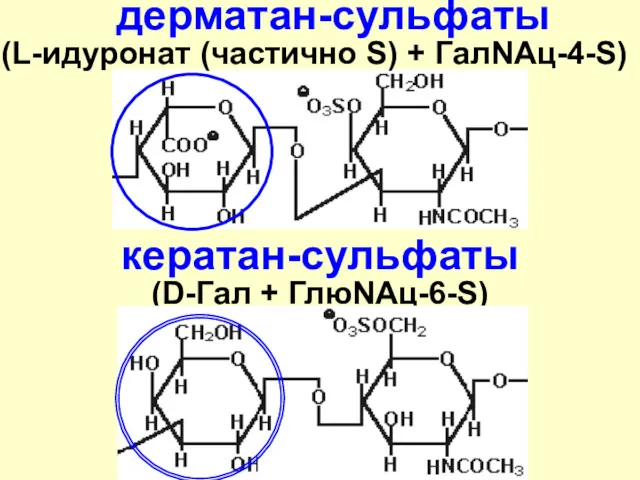
- 49. дерматан-сульфаты (L-идуронат (частично S) + ГалNAц-4-S) кератан-сульфаты (D-Гал + ГлюNАц-6-S)
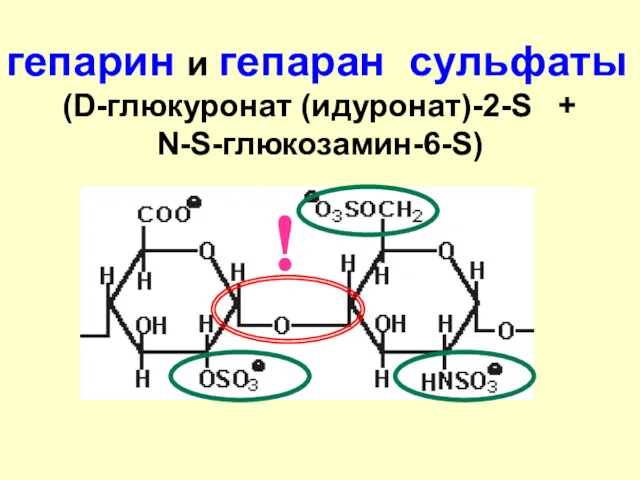
- 50. гепарин и гепаран сульфаты (D-глюкуронат (идуронат)-2-S + N-S-глюкозамин-6-S) !
- 51. МУКОПОЛИСАХАРИДОЗЫ – это заболевания, обусловленные генетическим дефектом ферментативного расщепления углеводной части молекулы различных протеогликанов и накоплением
- 53. Скачать презентацию



































 Оболочки головного и спинного мозга. Ликвор и ликвородинамика
Оболочки головного и спинного мозга. Ликвор и ликвородинамика Плечелопаточный периартрит
Плечелопаточный периартрит История воспаления - это история медицины
История воспаления - это история медицины Противосудорожные средства
Противосудорожные средства Глаукома клиникасы, диагностика және емі
Глаукома клиникасы, диагностика және емі Первая помощь при прочих состояниях (ожоги, обморожения, отравления)
Первая помощь при прочих состояниях (ожоги, обморожения, отравления) Чреспищеводная электро кардио стимуляция
Чреспищеводная электро кардио стимуляция Бас миының ісінуі
Бас миының ісінуі Туберкулездің алдын алу
Туберкулездің алдын алу Мектепке дайындау
Мектепке дайындау Головные боли. Вопросы дифференциальной диагностики и лечения
Головные боли. Вопросы дифференциальной диагностики и лечения Балалардағы иммунды жүйе ерекшеліктері
Балалардағы иммунды жүйе ерекшеліктері Средства, действующие преимущественно на сердечно-сосудистую систему
Средства, действующие преимущественно на сердечно-сосудистую систему Повышенный риск кумуляции. Биологическое воздействие лекарств на организм. 7-тема СРИ
Повышенный риск кумуляции. Биологическое воздействие лекарств на организм. 7-тема СРИ Первая медицинская помощь общие сведения, ее правовые аспекты
Первая медицинская помощь общие сведения, ее правовые аспекты Возрастные особенности опорно-двигательной системы
Возрастные особенности опорно-двигательной системы Ауыз қуысы гигиенасының негізгі құралдары Тіс щеткалары
Ауыз қуысы гигиенасының негізгі құралдары Тіс щеткалары Переливание крови и кровезаменителей
Переливание крови и кровезаменителей Отек головного мозга
Отек головного мозга Глаукома глаз
Глаукома глаз Диспансерлік бақылау
Диспансерлік бақылау Steps to Rubber Dam Isolation in Restorative
Steps to Rubber Dam Isolation in Restorative Мышечная система у детей: анатомо-физиологические особенности, методы обследования
Мышечная система у детей: анатомо-физиологические особенности, методы обследования Инфекционно-токсический шок
Инфекционно-токсический шок Религиозные оценки новых репродуктивных технологии
Религиозные оценки новых репродуктивных технологии 20231031_zhiznennyy_tsikl_virusov
20231031_zhiznennyy_tsikl_virusov Бүйрек жеткіліксіздігі кезіндегі эфферентті емдеу
Бүйрек жеткіліксіздігі кезіндегі эфферентті емдеу Физическая активность и здоровье
Физическая активность и здоровье