Содержание
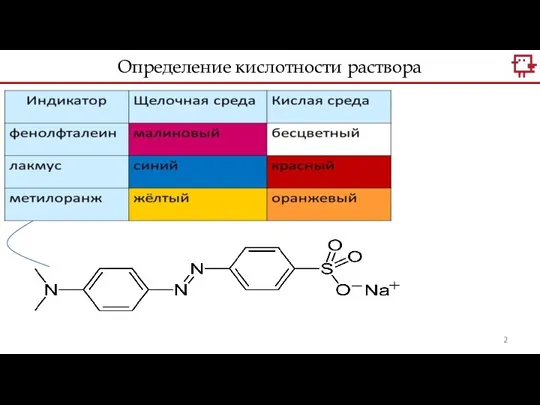
- 2. Определение кислотности раствора
- 3. Галогенид-ионы определяются при взаимодействиями с солями серебра: AgNO3 + KCl = KNO3 + AgCl (белый) AgNO3
- 4. Качественная реакция на соли меди: Cu2+ +2OH— → Cu(OH)2↓ Качественные реакции на сульфид-ион (осадки черного цвета):
- 5. Ba2+ + SO4 -2 → BaSO4↓ качественная реакция на соли бария; качественная реакция на сульфат-ионы; Белый
- 6. Al3+ + 3OH— = Al(OH)3↓ Zn2+ + 2OH— = Zn(OH)2↓ избыток щелочи: Al(OH)3 + NaOH =Na[Al(OH)]4;
- 7. 3Ag+ + PO43- → Ag3PO4↓ Осадок желтого цвета образуется при приливании AgNO3; растворим в кислотах; Другие
- 9. Скачать презентацию





 Алкены (олефины). 10 профиль. Лекция №1
Алкены (олефины). 10 профиль. Лекция №1 Побочная подгруппа. 8 группы
Побочная подгруппа. 8 группы Щелочи
Щелочи Химическая промышленность. 9 класс
Химическая промышленность. 9 класс Углерод и кремний
Углерод и кремний Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Химическая связь и ее типы
Химическая связь и ее типы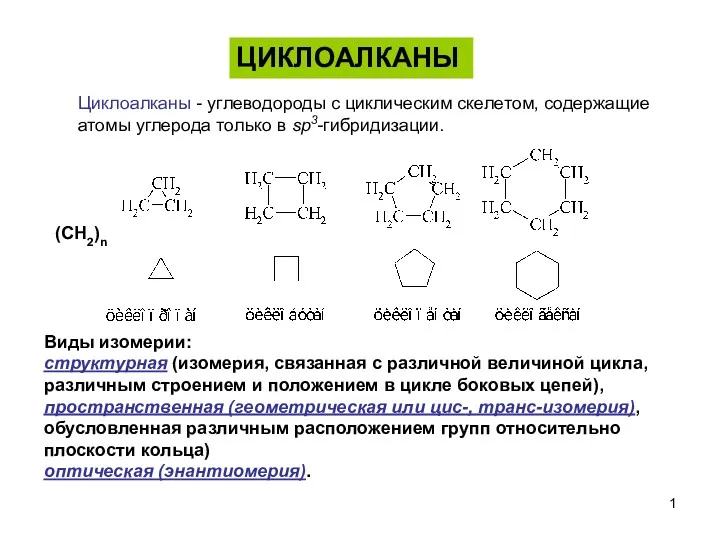 Циклоалканы
Циклоалканы Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты
Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты Практическая работа № 3. Получение, собирание и распознавание газов
Практическая работа № 3. Получение, собирание и распознавание газов Химическая промышленность России
Химическая промышленность России Общая характеристика металлов
Общая характеристика металлов Азотная кислота. Соли азотной кислоты. Получение и применение (9 класс)
Азотная кислота. Соли азотной кислоты. Получение и применение (9 класс)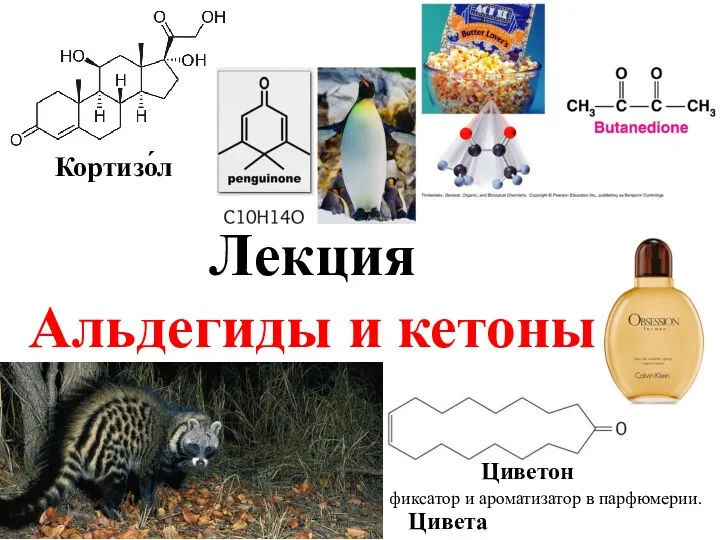 Альдегиды и кетоны. Циветон
Альдегиды и кетоны. Циветон Кислород
Кислород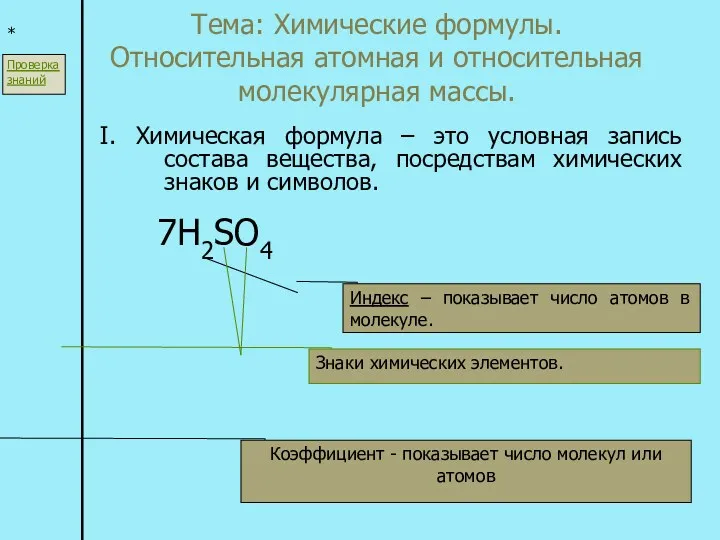 Химические формулы. Относительная атомная и относительная молекулярная массы
Химические формулы. Относительная атомная и относительная молекулярная массы Silicon. Silicate minerals. Weathering
Silicon. Silicate minerals. Weathering Возникновение и развитие органической химии. Теория химического строения. Структурные формулы
Возникновение и развитие органической химии. Теория химического строения. Структурные формулы Комплексиметрическое титрование
Комплексиметрическое титрование НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ сложные эфиры
сложные эфиры Классификация химических реакций, протекающих с изменением состава веществ
Классификация химических реакций, протекающих с изменением состава веществ Магний (Mg)
Магний (Mg) Реакции ионного обмена
Реакции ионного обмена Соединения железа
Соединения железа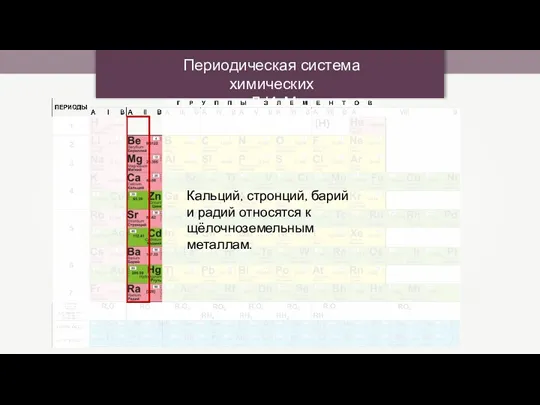 Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Organic compounds: nomenclature
Organic compounds: nomenclature Месторождения нефрита
Месторождения нефрита