Слайд 2

Слайд 3
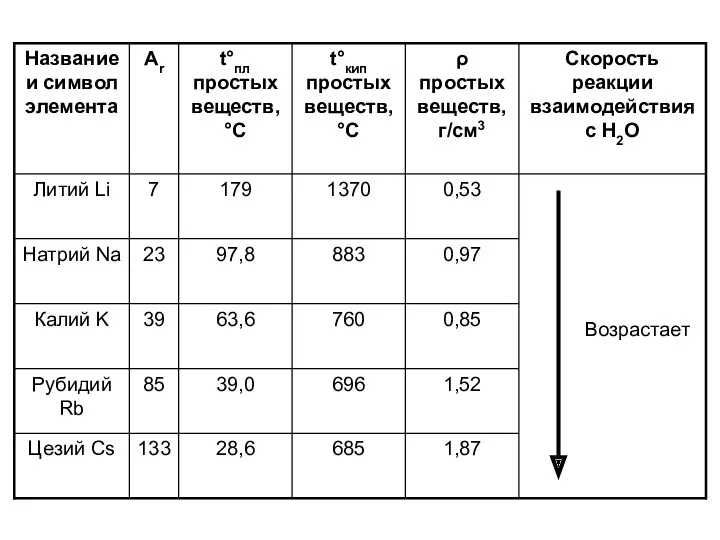
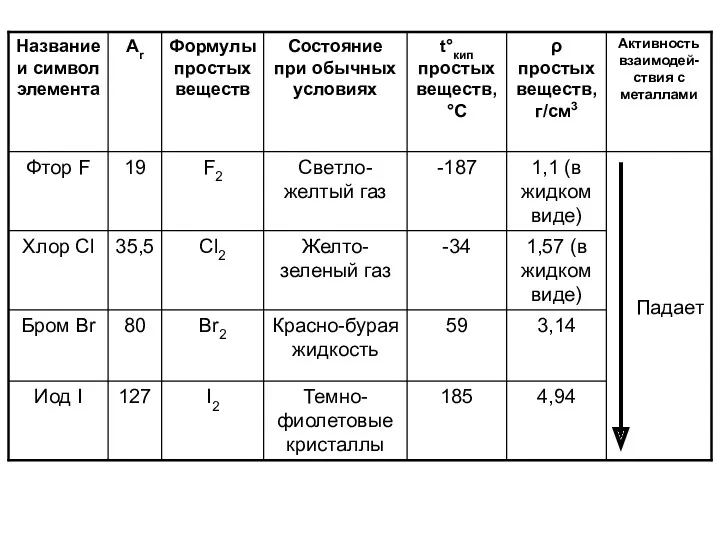
Отличительные физические свойства соответствующих простых веществ
Слайд 4
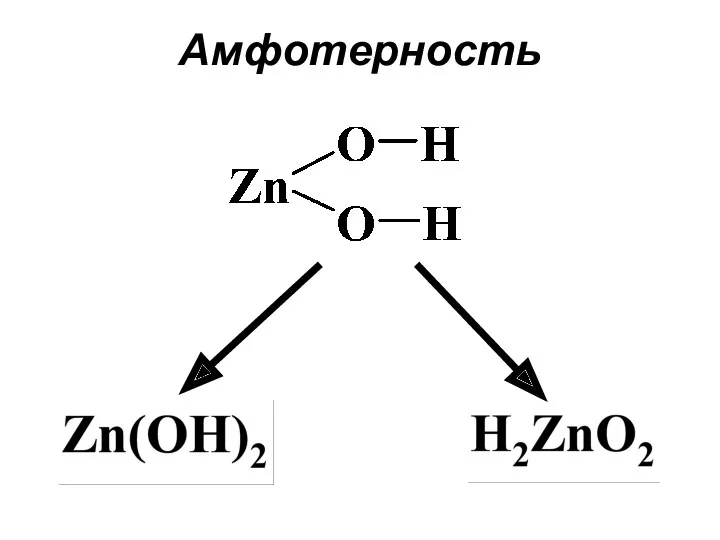
Слайд 5

Оксиды и гидроксиды, которые способные реагировать и с кислотами, и со
щелочами, называют амфотерными
(от греч. “amphoteros” – оба, тот и другой)
Слайд 6

Оксиды и гидроксиды каких элементов относят к амфотерным?
К амфотреным относят оксиды
и гидроксиды металлов с валентностью III и IV, а также ZnO, BeO, PbO, SnO, Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2
Слайд 7
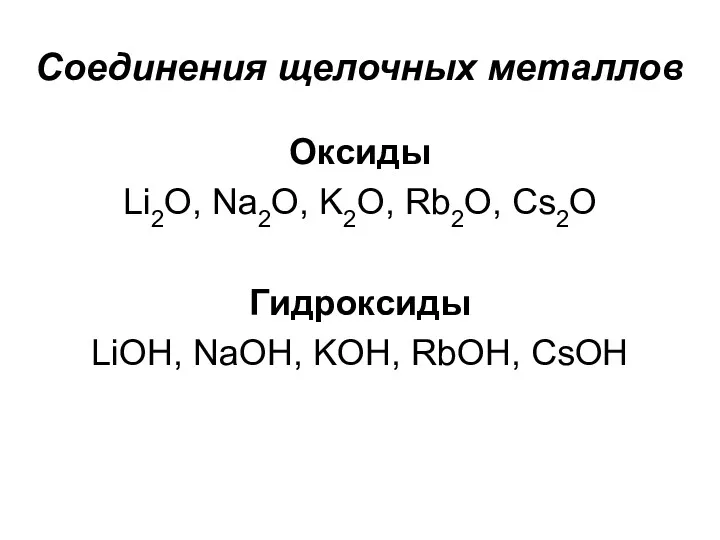
Соединения щелочных металлов
Оксиды
Li2O, Na2O, K2O, Rb2O, Cs2O
Гидроксиды
LiOH, NaOH, KOH, RbOH, CsOH
Слайд 8
Слайд 9

Соединения галогенов
Водородные соединения
HF, HCl, HBr, HI, HAt
Галогениды металлов
NaF, NaCl, NaBr,
NaI, NaAt
AlF3, AlCl3, AlBr3, AlI3, AlAt3
Слайд 10









 Молекулы и атомы
Молекулы и атомы Сушка в химической промышленности. Свойства влажного воздуха
Сушка в химической промышленности. Свойства влажного воздуха Превращения веществ. Роль химии в жизни человека
Превращения веществ. Роль химии в жизни человека Қатты күйдегі препараттар
Қатты күйдегі препараттар Углерод. Аллотропные состояния углерода
Углерод. Аллотропные состояния углерода Основания, их классификация и свойства в свете ТЭД
Основания, их классификация и свойства в свете ТЭД Химический элемент таблицы Менделеева - Азот
Химический элемент таблицы Менделеева - Азот Алканы нефти. Содержание алканов в нефтяных фракциях
Алканы нефти. Содержание алканов в нефтяных фракциях Analytical chemistry methods
Analytical chemistry methods Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов. Ионная связь
Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов. Ионная связь 20231104_prezentatsiya_teoriya_elektroliticheskoy_dissotsiatsii
20231104_prezentatsiya_teoriya_elektroliticheskoy_dissotsiatsii Історія хімії
Історія хімії Тепловой эффект химических реакций
Тепловой эффект химических реакций Углеводороды. Арены (ароматические углеводороды)
Углеводороды. Арены (ароматические углеводороды) Жану процесі
Жану процесі Применение родия (Rh)
Применение родия (Rh) Производные хинолина и хинуклидина, производные 4-замещенных хинолина
Производные хинолина и хинуклидина, производные 4-замещенных хинолина Химикаты для сельского хозяйства
Химикаты для сельского хозяйства Окислительно-восстановительные реакции (ОВР). Лекция 6
Окислительно-восстановительные реакции (ОВР). Лекция 6 Основные сведения о строении атома
Основные сведения о строении атома Сарқынды сулардан ренийді бөлу әдісі. құмда мысты қайта өңдеу
Сарқынды сулардан ренийді бөлу әдісі. құмда мысты қайта өңдеу Тыңайтқышты тиімді пайдалансақ
Тыңайтқышты тиімді пайдалансақ Уравнения химических реакций
Уравнения химических реакций Серная кислота и её свойства
Серная кислота и её свойства Искусственные полимеры
Искусственные полимеры Классификация химических реакций. 8 класс
Классификация химических реакций. 8 класс Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов Күйдіргіш натрий
Күйдіргіш натрий