Содержание
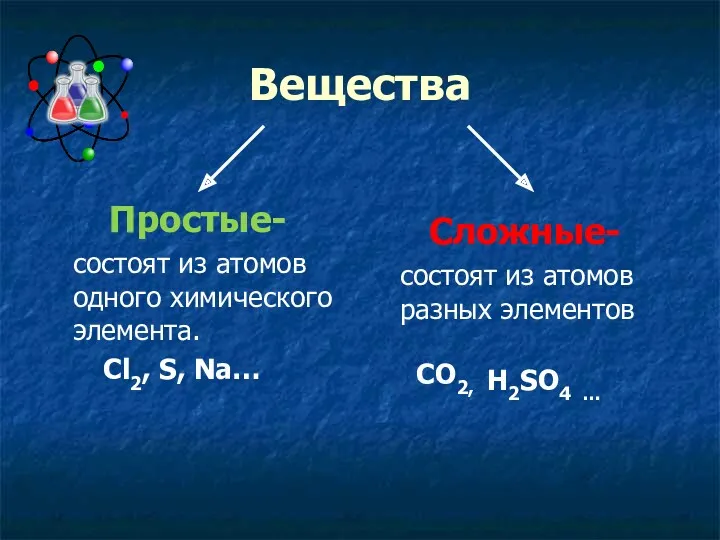
- 2. Вещества Простые- состоят из атомов одного химического элемента. Cl2, S, Na… Сложные- состоят из атомов разных
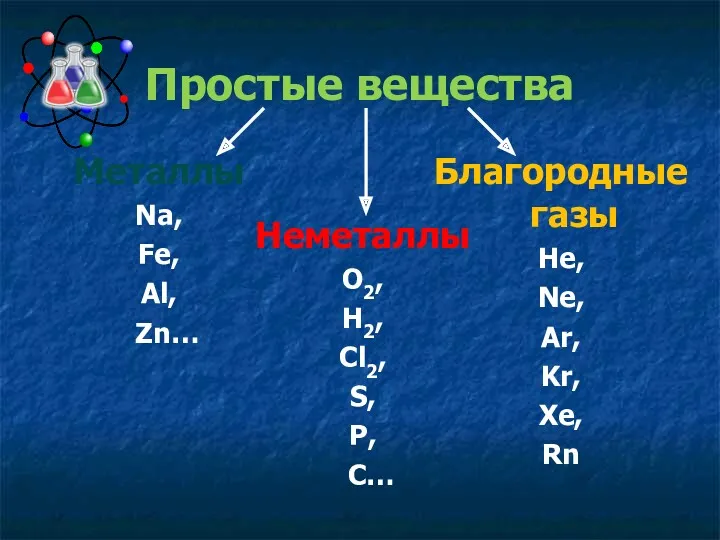
- 3. Благородные газы He, Ne, Ar, Kr, Xe, Rn Простые вещества Металлы Na, Fe, Al, Zn… Неметаллы
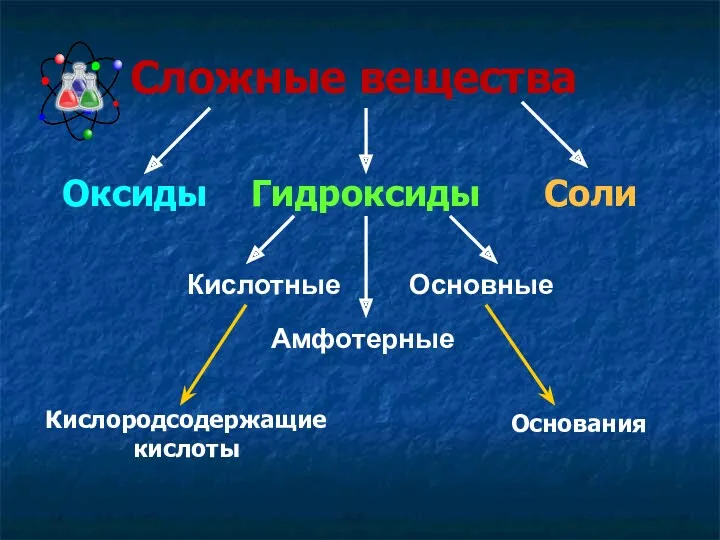
- 4. Сложные вещества Оксиды Гидроксиды Соли Кислотные Основные Амфотерные Кислородсодержащие кислоты Основания
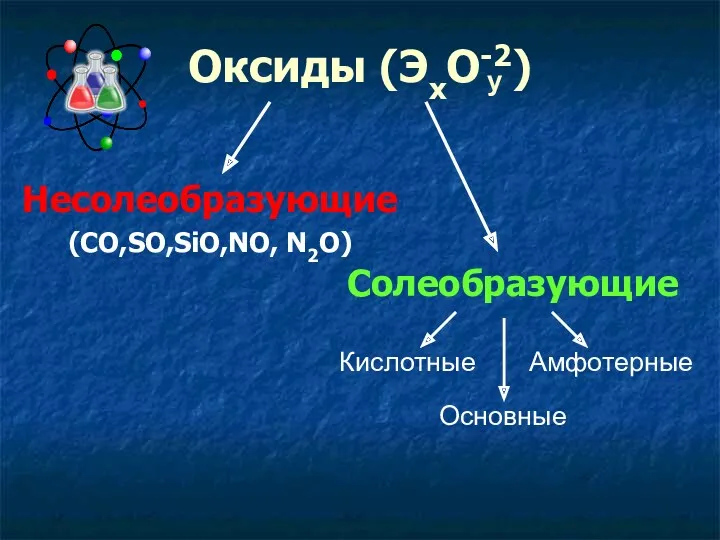
- 5. Несолеобразующие (СO,SO,SiO,NO, N2O) Солеобразующие Кислотные Основные Амфотерные Оксиды (ЭхО-2) y
- 6. Основные оксиды- оксиды металлов со степенью окисления +1(I),+2(II) Na2O Li2O K2O MgO CaO BaO CrO FeO
- 7. Кислотные оксиды Оксиды неметаллов: SO2 SO3 CO2 P2O5 SiO2 N2O3 N2O5 Оксиды металлов со степенью окисления
- 8. Амфотерные оксиды оксиды металлов со степенью окисления +3(III),+4(IV) (искл.)+2 ZnO, BeO,GeO, SnO,PbO Al2O3 SnO2 PbO2 Fe2O3
- 9. Кислоты (НхR) HNO3 – азотная HNO2 – азотистая H2SO4 – серная H2SO3 – сернистая H2SiO3 –
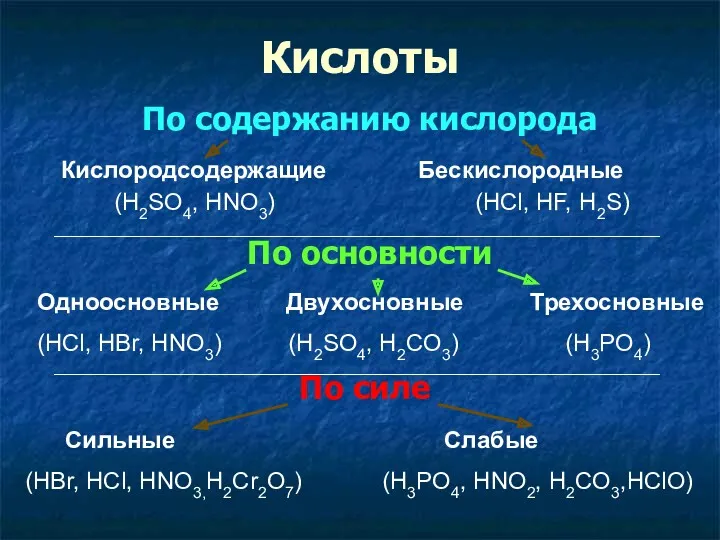
- 10. Кислоты По содержанию кислорода По основности По силе Кислородсодержащие Бескислородные (H2SO4, HNO3) (HCl, HF, H2S) Одноосновные
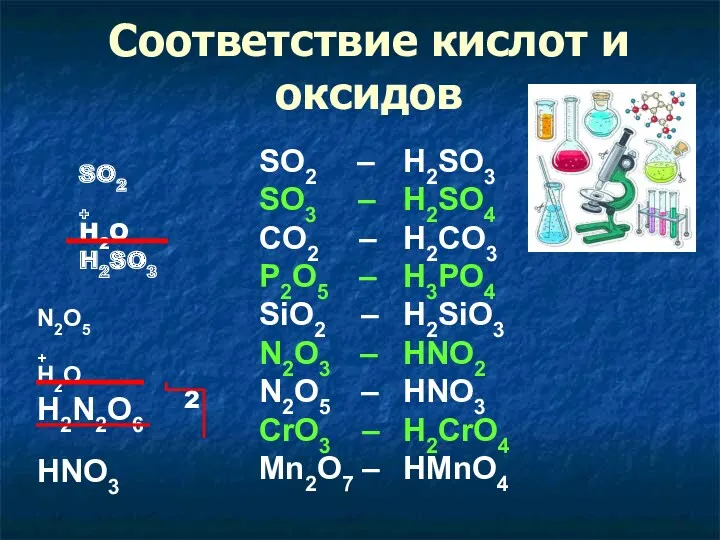
- 11. Соответствие кислот и оксидов SO2 – H2SO3 SO3 – H2SO4 CO2 – H2CO3 P2O5 – H3PO4
- 12. Основания (Ме(ОН)x) По растворимости в воде По силе Растворимые – щелочи Нерастворимые (NaOH, KOH, Ba(OH)2) (Fe(OH)2,
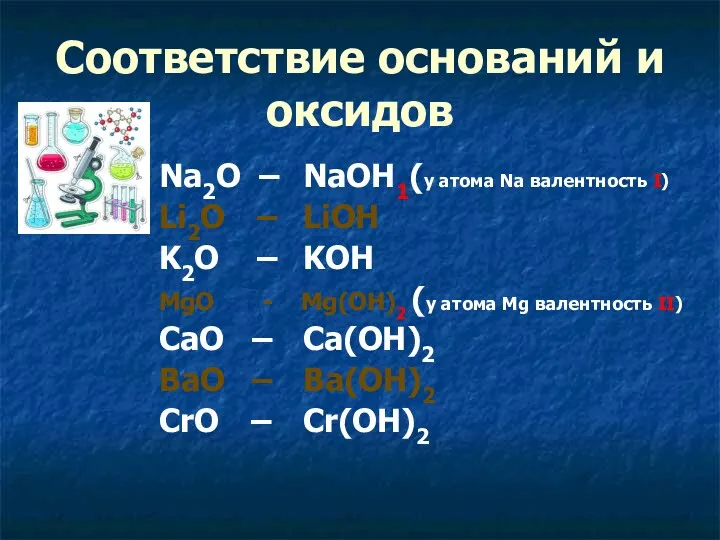
- 13. Соответствие оснований и оксидов Na2O – NaOH1(у атома Na валентность I) Li2O – LiOH K2O –
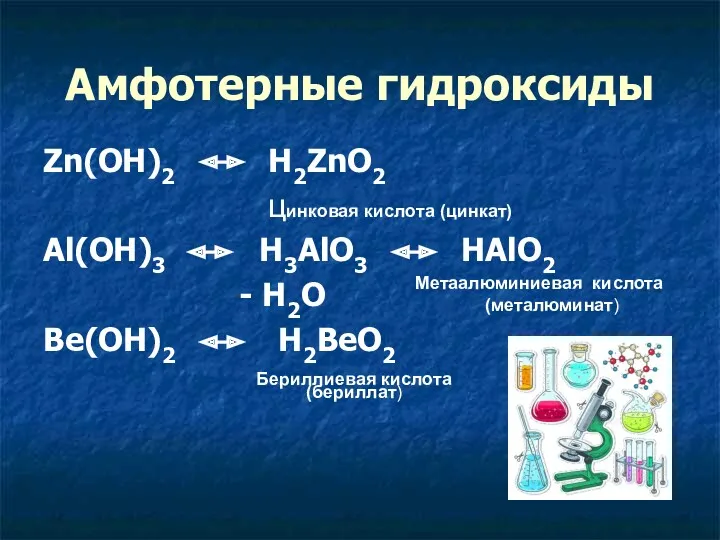
- 14. Амфотерные гидроксиды Zn(OH)2 H2ZnO2 цинковая кислота (цинкат) Al(OH)3 H3AlO3 HAlO2 - H2O Be(OH)2 H2BeO2 Метаалюминиевая кислота
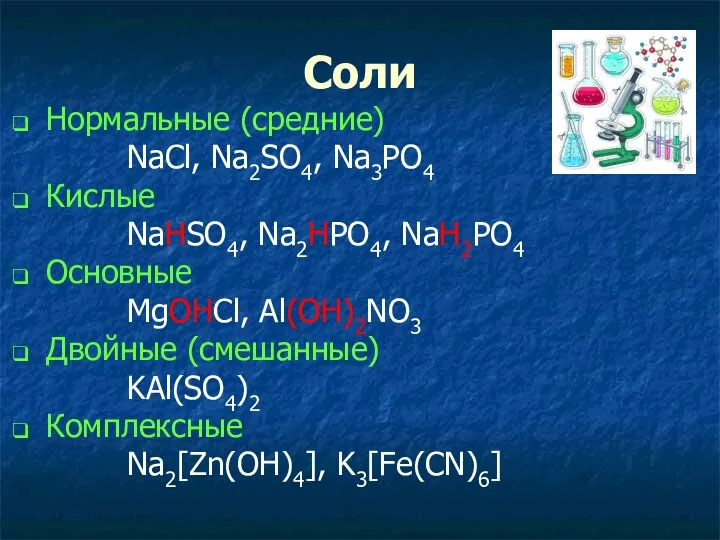
- 15. Соли Нормальные (средние) NaCl, Na2SO4, Na3PO4 Кислые NaHSO4, Na2HPO4, NaH2PO4 Основные MgOHCl, Al(OH)2NO3 Двойные (смешанные) KAl(SO4)2
- 16. Проверим наши знания. Разнесите формулы из списка по предложенным ниже колонкам, дайте названия веществам. HNO3; KOH;
- 18. Скачать презентацию






 Кремний и его соединения для 11 класса
Кремний и его соединения для 11 класса Волокнистое сырьё. Технологические и эксплуатационные свойства
Волокнистое сырьё. Технологические и эксплуатационные свойства Поляризация электродов
Поляризация электродов Этилен. Углеводороды ряда этилена
Этилен. Углеводороды ряда этилена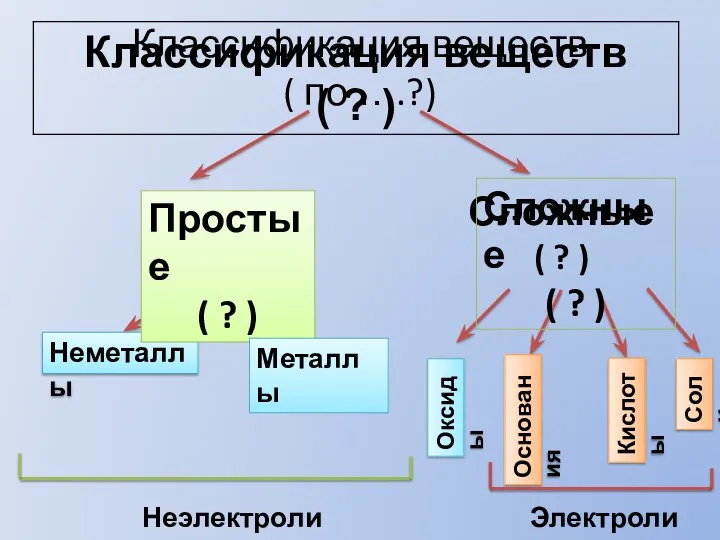 Классификация веществ
Классификация веществ Введение в коллоидную химию. Основные понятия и закономерности
Введение в коллоидную химию. Основные понятия и закономерности Щавелевая кислота
Щавелевая кислота Електронні і графічні електронні формули атомів s-, р-, d- елементів. Принцип мінімальної енергії
Електронні і графічні електронні формули атомів s-, р-, d- елементів. Принцип мінімальної енергії Щелочные металлы. (9 класс)
Щелочные металлы. (9 класс) Титан және оның қорытпалары. Титаннан жасалған құралдар
Титан және оның қорытпалары. Титаннан жасалған құралдар Хозяйственный механизм НГХК
Хозяйственный механизм НГХК Химия элементов VIIA группы
Химия элементов VIIA группы Типы химических реакций. Реакции обмена
Типы химических реакций. Реакции обмена Правила роботи на уроці
Правила роботи на уроці Аммиак (9 класс)
Аммиак (9 класс) Енергетичний баланс процесу горіння
Енергетичний баланс процесу горіння Аминокислоты
Аминокислоты Chemical reactions and heat. (Chapter 1)
Chemical reactions and heat. (Chapter 1) Биологически важные гетероциклы
Биологически важные гетероциклы Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода
Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода Тепловой эффект химических реакций
Тепловой эффект химических реакций Совйства спиртов. 10 класс
Совйства спиртов. 10 класс Модифицированные природные полимеры. Их свойства
Модифицированные природные полимеры. Их свойства Кондуктометрия и кондуктометрическое титрование
Кондуктометрия и кондуктометрическое титрование Физические свойства минералов
Физические свойства минералов Концентраційні межі поширення полум'я
Концентраційні межі поширення полум'я Матеріали на основі аерогелів: класифікація, підходи до синтезу та сфери застосування
Матеріали на основі аерогелів: класифікація, підходи до синтезу та сфери застосування Щелочноземельные металлы. Металлы II А подгруппы
Щелочноземельные металлы. Металлы II А подгруппы