Содержание
- 2. Коррозия — это разрушение металлов в результате его физико-химического взаимодействия с окружающей средой. При этом металлы
- 3. Коррозия — самопроизвольный процесс и соответственно протекает с уменьшением энергии Гиббса системы. Химическая энергия реакции коррозионного
- 4. Химическая коррозия Химическая коррозия, характерна для сред, не проводящих электрический ток. При химической коррозии происходит прямое
- 5. Уравнение реакции окисления металлов кислородом можно записать в общем виде:
- 6. Электрохимическая коррозия Электрохимическая коррозия характерна для сред, имеющих ионную проводимость. При электрохимической коррозии процесс взаимодействия металла
- 7. Электрохимическая коррозия может протекать: а) в электролитах — в водных растворах солей, кислот, щелочей, в морской
- 8. Электроны в процессе коррозии не выходят из корродирующего металла, а двигаются внутри металла. Химическая энергия реакции
- 9. Механизм электрохимической коррозии Коррозия металлов в средах, имеющих ионную проводимость, протекает через анодное окисление металлов А:
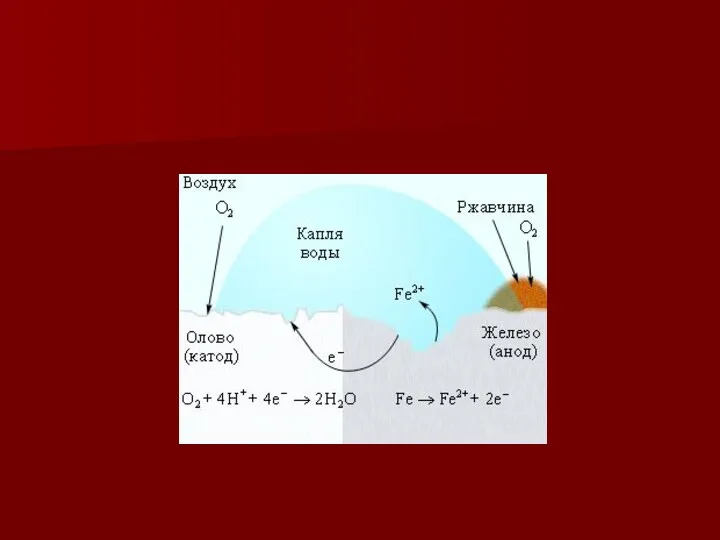
- 10. Наиболее часто при коррозии наблюдается восстановление молекул кислорода: а) в нейтральной или щелочной среде: ; б
- 11. Ионы или молекулы, которые восстанавливаются на катоде, называются деполяризаторами. При атмосферной коррозии - коррозия во влажном
- 12. ЭДС системы равна разности потенциалов окислителя и восстановителя: Е = - = - , Чем больше
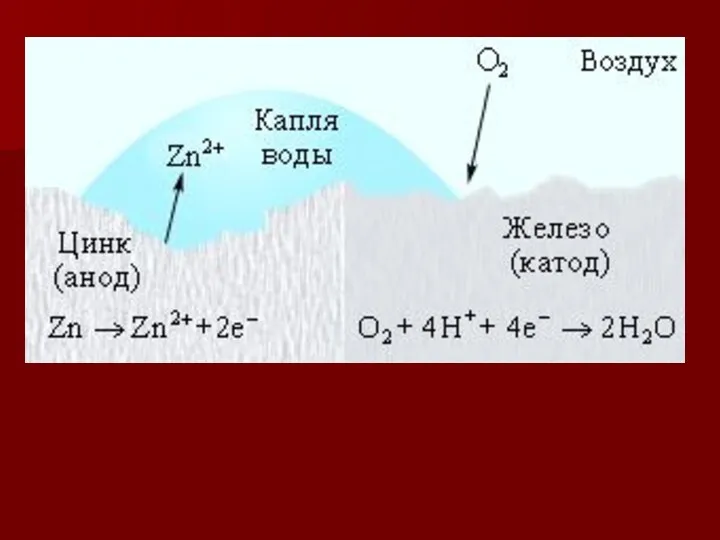
- 13. Пример 1. Как происходит коррозия цинка, находящегося в контакте с железом в нейтральном и кислом растворе.
- 15. а) в кислой среде (А) Zn/ Н+ / Fe (К) А: Zn0 - 2e= Zn2+ К:
- 17. ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ Коррозию металлов можно затормозить изменением потенциала металла, пассивированием металла, снижением концентрации окислителя,
- 18. Все методы защиты условно делятся на следующие группы: а) легирование металлов; б) защитные покрытия (металлические, неметаллические);
- 19. Легирование металлов - эффективный (хотя и дорогой) метод повышения коррозионной стойкости металлов. При легировании в состав
- 20. В качестве таких компонентов применяют хром, никель, вольфрам и др. К коррозионностойким сплавам, например, относятся нержавеющие
- 21. Защитные покрытия Защитные покрытия. Слои, искусственно создаваемые на поверхности металлических изделий и сооружений для предохранения их
- 22. а) Металлические покрытия. Материалами для металлических защитных покрытий могут быть как чистые металлы (цинк, кадмий, алюминий,
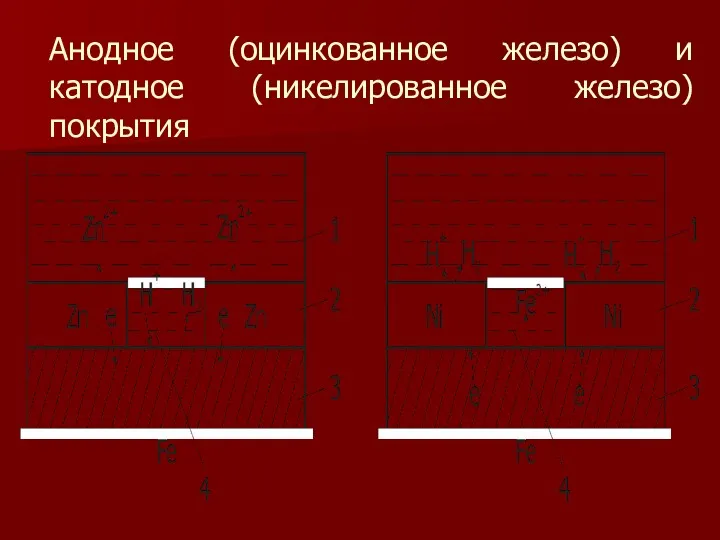
- 23. К катодным покрытиям относятся покрытия, потенциалы которых в данной среде имеют более положительное значение, чем потенциал
- 24. Анодное (оцинкованное железо) и катодное (никелированное железо) покрытия
- 25. Для получения металлических защитных покрытий применяются различные способы: электрохимический (гальванические покрытия); погружение в расплавленный металл. Из
- 26. б) К органическим покрытиям относятся лакокрасочные покрытия, покрытия смолами, пластмассами, полимерными пленками, резиной. Лакокрасочные покрытия наиболее
- 27. Образование на поверхности металлических изделий защитных оксидных пленок в технике называют оксидированием. Так, например, процессы нанесения
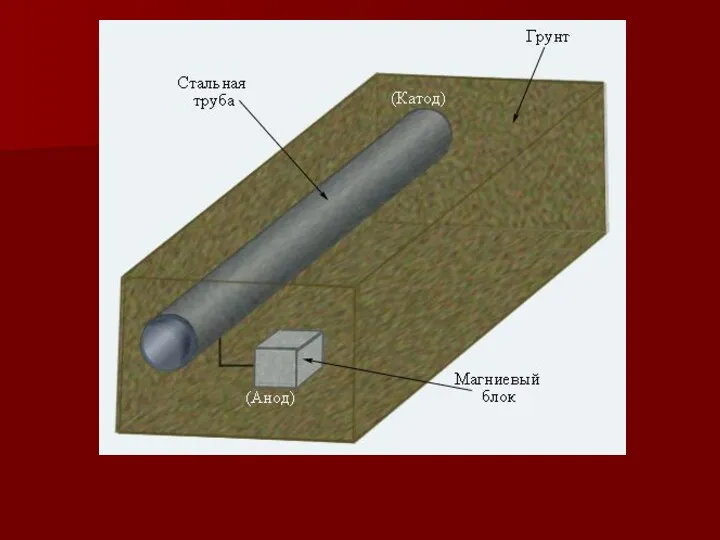
- 28. Электрохимическая защита (протекторная) осуществляется присоединением к защищаемой конструкции металла с более отрицательным значением электродного потенциала. Такие
- 30. Катодная защита Сущность катодной защиты заключается в том, что защищаемое изделие подключается к отрицательному полюсу внешнего
- 31. Изменение свойств коррозионной среды. Для снижения агрессивности среды уменьшают концентрацию компонентов, опасных в коррозионном отношении. Например,
- 32. Для защиты от коррозии широко применяют ингибиторы. Ингибитором называется вещество, при добавлении которого в среду, где
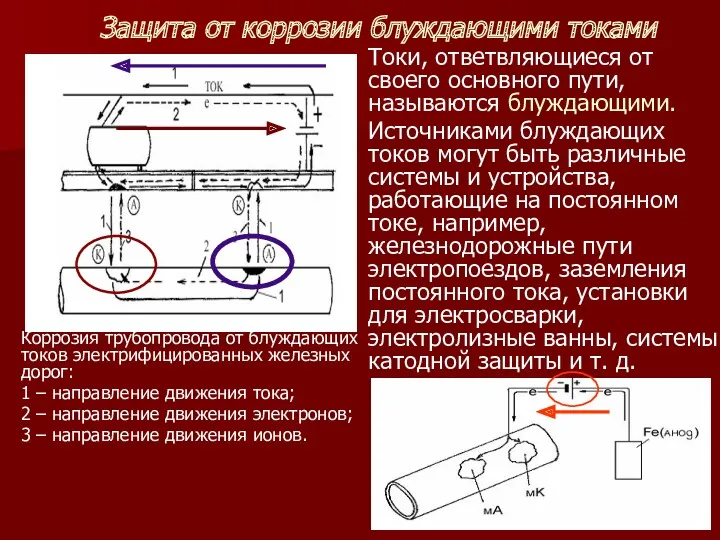
- 33. Защита от коррозии блуждающими токами Токи, ответвляющиеся от своего основного пути, называются блуждающими. Источниками блуждающих токов
- 35. Скачать презентацию



























 Нуклеопротеины
Нуклеопротеины Аминокислоты. Классификация аминокислот
Аминокислоты. Классификация аминокислот Хімічні явища в побуті
Хімічні явища в побуті Химическая связь. Лекция 2-3
Химическая связь. Лекция 2-3 Химиялық элементтердің тірі және өлі табиғатта таралуы
Химиялық элементтердің тірі және өлі табиғатта таралуы Трансформация ионной химической связи в металлическую при восстановлении металлов в комплексных оксидах
Трансформация ионной химической связи в металлическую при восстановлении металлов в комплексных оксидах Химия и война. Альманах
Химия и война. Альманах Основания - свойства ТЭД
Основания - свойства ТЭД Положение в ПСХЭ и строение атома
Положение в ПСХЭ и строение атома Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Загадочный Менделеев
Загадочный Менделеев Изомерия биоорганических соединений. Структура и функции биолекул
Изомерия биоорганических соединений. Структура и функции биолекул Типы химических реакций. Опыты
Типы химических реакций. Опыты Методические подходы к решению химических задач. Задание 34
Методические подходы к решению химических задач. Задание 34 Введение в химию. 8 класс
Введение в химию. 8 класс Дифузія в побуті
Дифузія в побуті Одноосновные карбоновые кислоты. Строение, физические свойства, номенклатура
Одноосновные карбоновые кислоты. Строение, физические свойства, номенклатура Химиялық байланыс және заттардың құрылымдық түрлі сатылары
Химиялық байланыс және заттардың құрылымдық түрлі сатылары Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Алюминий
Алюминий Физико-химические методы анализа. Лекция 3
Физико-химические методы анализа. Лекция 3 Алюминий IIIА топ элементі
Алюминий IIIА топ элементі Электролиз
Электролиз Механизмы трансформации энергии в фотосинтезе
Механизмы трансформации энергии в фотосинтезе Углеводороды. Значение углеводородов
Углеводороды. Значение углеводородов Түймедақ гүлімен құрғақ теріге арналған ылғалдандырушы крем дайындау
Түймедақ гүлімен құрғақ теріге арналған ылғалдандырушы крем дайындау Монокристаллы CdTe и твердые растворы на его основе. Свойства, получение, применение
Монокристаллы CdTe и твердые растворы на его основе. Свойства, получение, применение