Содержание
- 2. сложные химические соединения, состоящие из ионов металлов и связанных с ними гидроксид-ионов Основания -
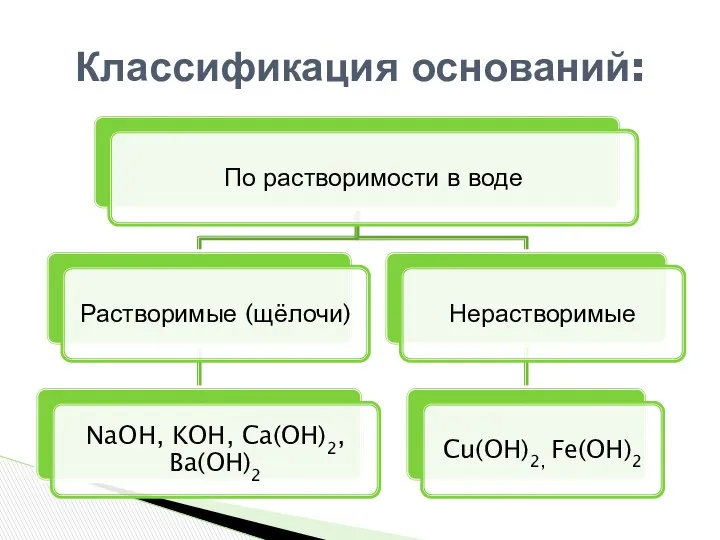
- 3. Классификация оснований:
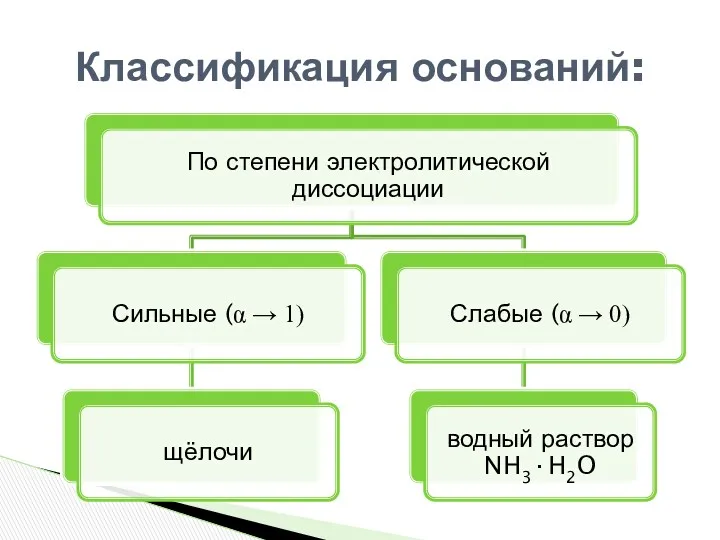
- 4. Классификация оснований:
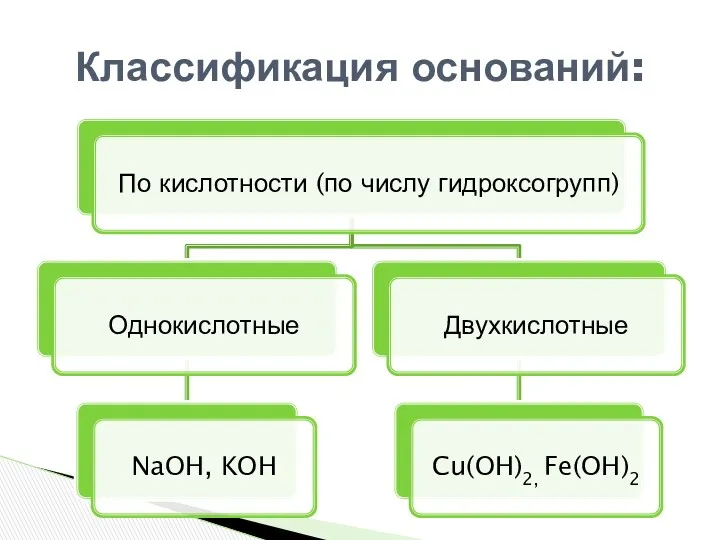
- 5. Классификация оснований:
- 6. При обычных условиях все основания, кроме раствора аммиака в воде, представляют собой твёрдые вещества имеющие различную
- 7. Какими бы разными ни были основания, все они состоят из ионов металла и гидроксогрупп, число которых
- 8. 1) Основание + кислота → соль + вода (реакция обмена, нейтрализации) Реакция протекает между любыми кислотами
- 9. 2) Щёлочь + оксид неметалла → соль + вода (реакция обмена) Реакция протекает между щелочами и
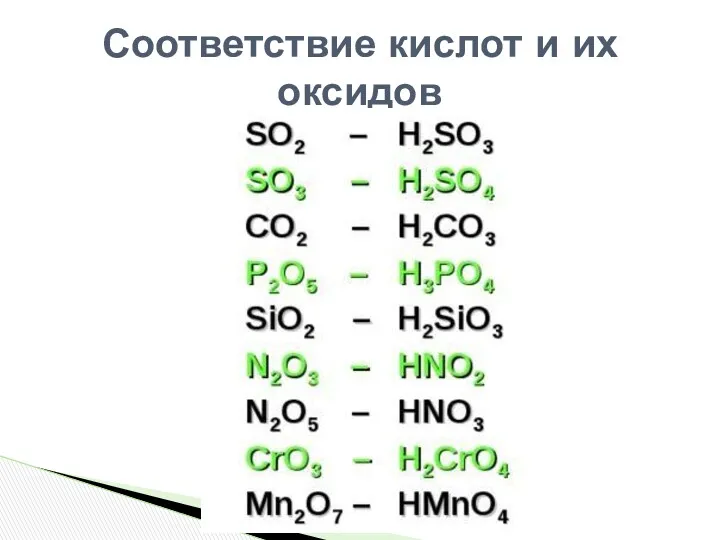
- 10. Соответствие кислот и их оксидов
- 11. 3) щёлочь + соль → новая соль + новое основание (реакция обмена) условие: должен образоваться ↓
- 12. 4) Разложение нерастворимых оснований (при нагревании) Fe(OH)2 → FeO + H2O Нерастворимые основания разлагаются на оксид
- 14. Скачать презентацию







 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей