Содержание
- 2. Поверхностные явления – эффекты и особенности поведения веществ, которые наблюдаются на поверхности раздела фаз. Поверхностные явления
- 3. Молекулы на поверхности стремятся «втянуться» внутрь – поверхность раздела уменьшается, а поверхностная энергия увеличивается. Поверхностная энергия
- 4. Физический смысл поверхностного натяжения Энергетическая трактовка: поверхностное натяжение равно работе, затраченной на образование единицы поверхности: Силовое
- 5. Благодаря поверхностному натяжению капля жидкости в свободном падении принимает сферическую форму.
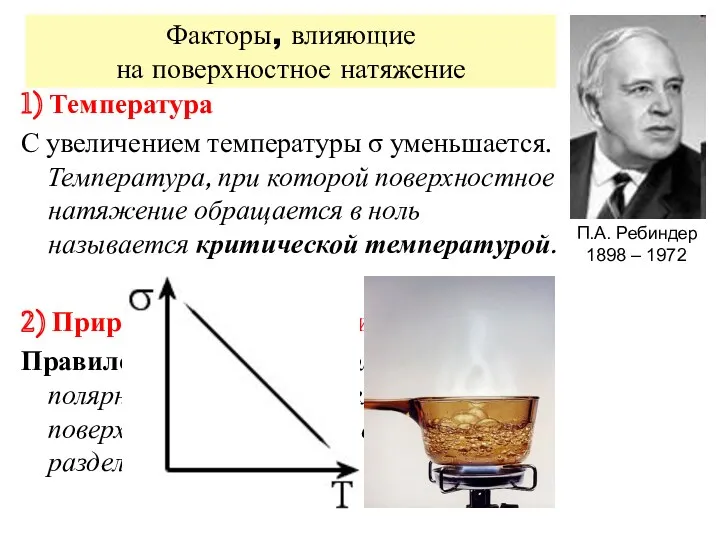
- 6. Факторы, влияющие на поверхностное натяжение 1) Температура С увеличением температуры σ уменьшается. Температура, при которой поверхностное
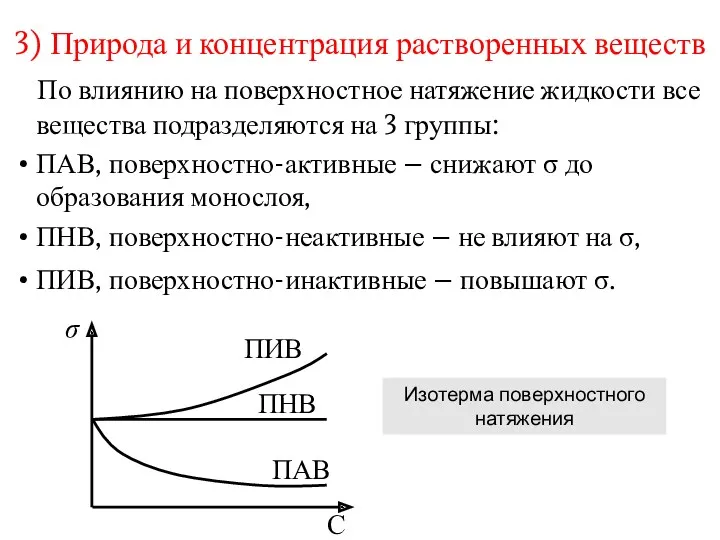
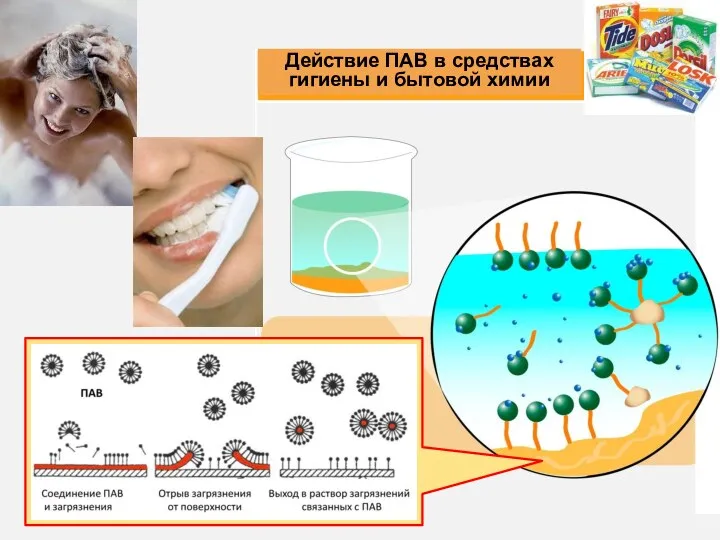
- 7. 3) Природа и концентрация растворенных веществ По влиянию на поверхностное натяжение жидкости все вещества подразделяются на
- 8. ПИВ - неорганические вещества (электролиты) Ионы хорошо гидратируются, поэтому втягиваются в глубину раствора и усиливают полярные
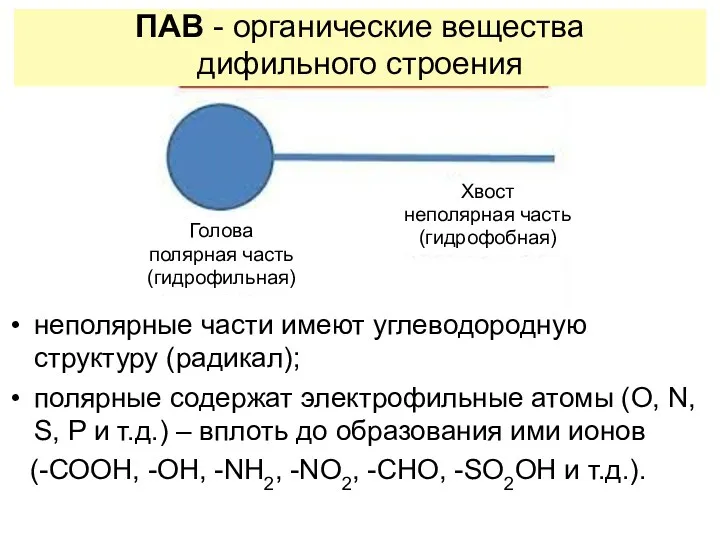
- 9. неполярные части имеют углеводородную структуру (радикал); полярные содержат электрофильные атомы (O, N, S, P и т.д.)
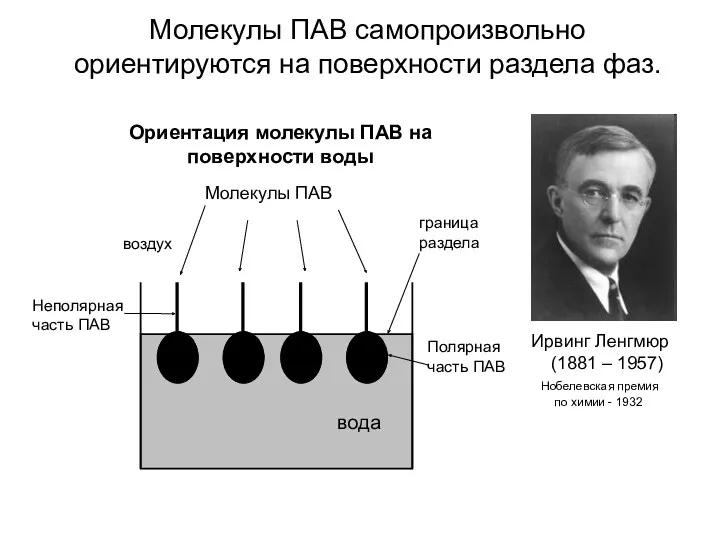
- 10. Молекулы ПАВ самопроизвольно ориентируются на поверхности раздела фаз. Ирвинг Ленгмюр (1881 – 1957) Нобелевская премия по
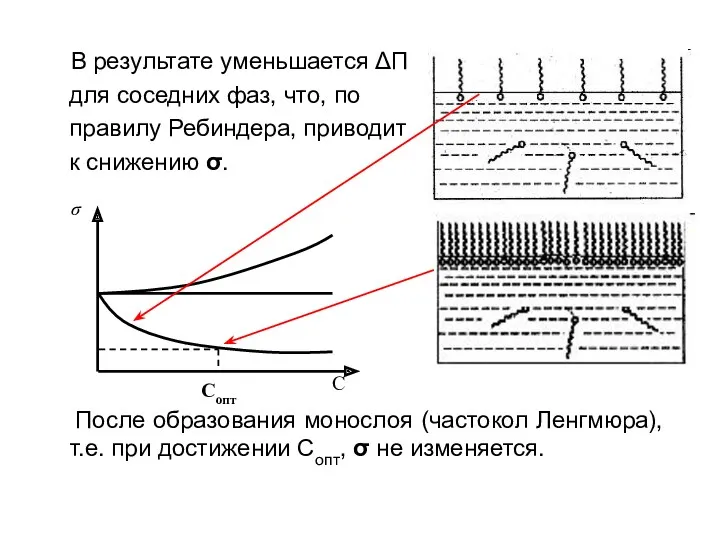
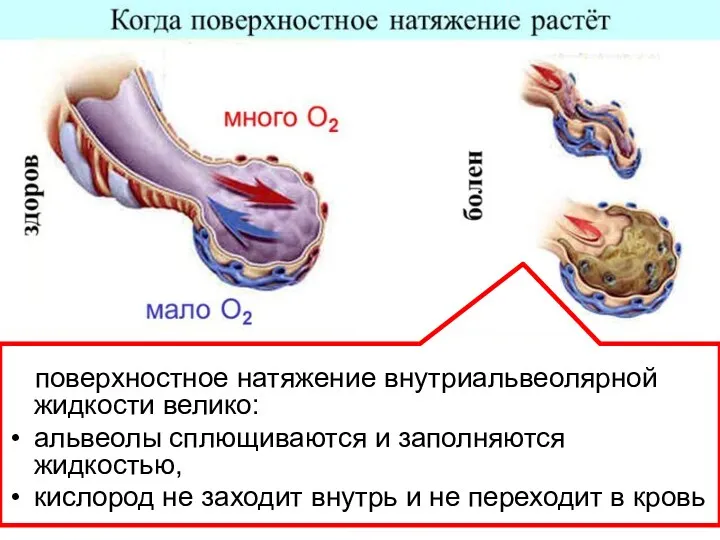
- 11. В результате уменьшается ΔП для соседних фаз, что, по правилу Ребиндера, приводит к снижению σ. После
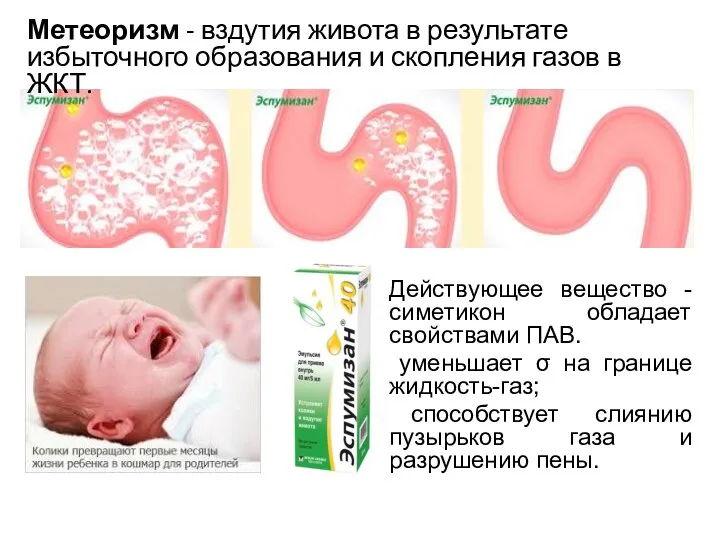
- 12. Действующее вещество - симетикон обладает свойствами ПАВ. уменьшает σ на границе жидкость-газ; способствует слиянию пузырьков газа
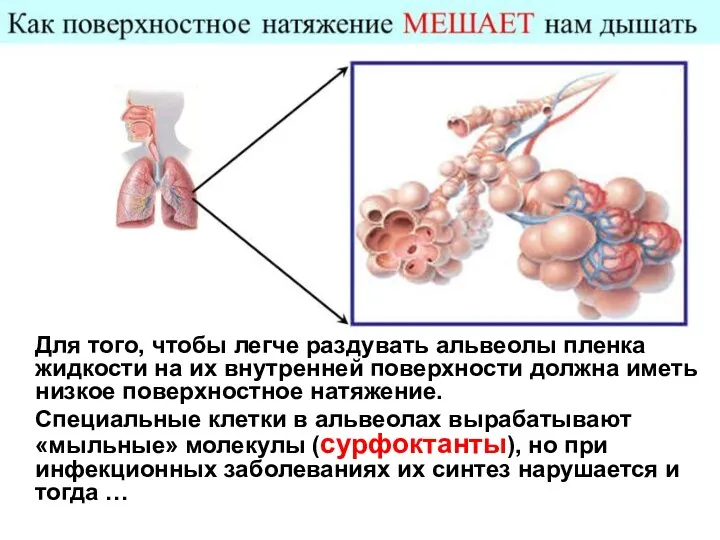
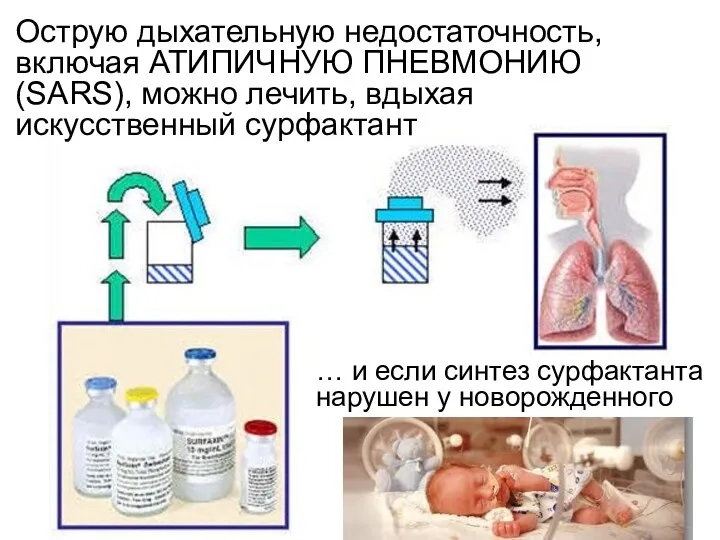
- 15. Острую дыхательную недостаточность, включая АТИПИЧНУЮ ПНЕВМОНИЮ (SARS), можно лечить, вдыхая искусственный сурфактант … и если синтез
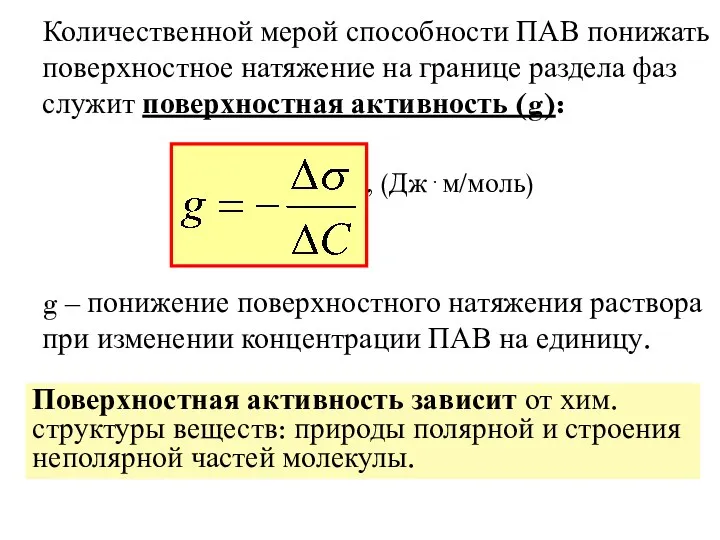
- 17. Количественной мерой способности ПАВ понижать поверхностное натяжение на границе раздела фаз служит поверхностная активность (g): ,
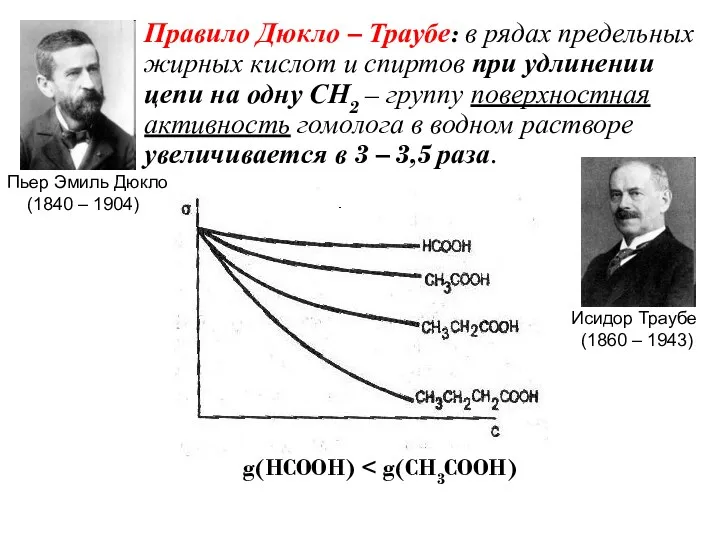
- 18. Правило Дюкло – Траубе: в рядах предельных жирных кислот и спиртов при удлинении цепи на одну
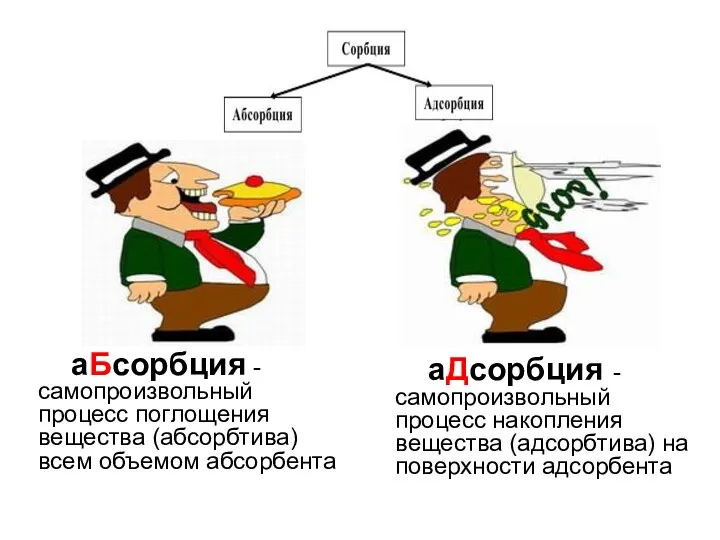
- 19. аБсорбция - самопроизвольный процесс поглощения вещества (абсорбтива) всем объемом абсорбента аДсорбция - самопроизвольный процесс накопления вещества
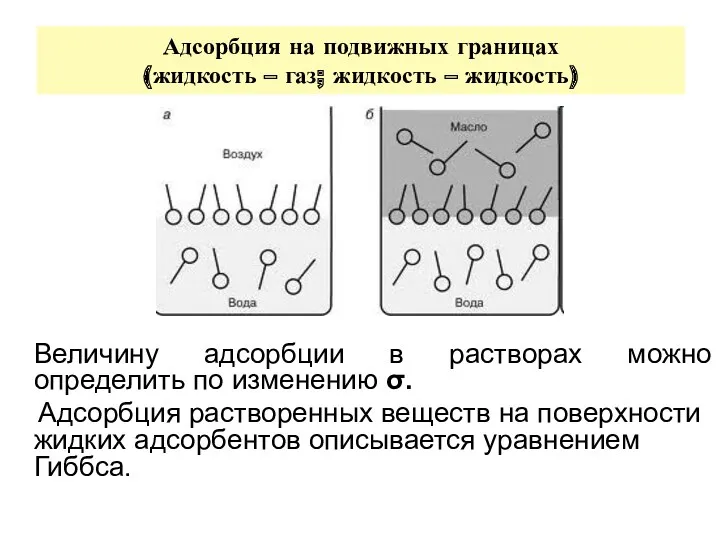
- 20. Адсорбция на подвижных границах (жидкость – газ; жидкость – жидкость) Величину адсорбции в растворах можно определить
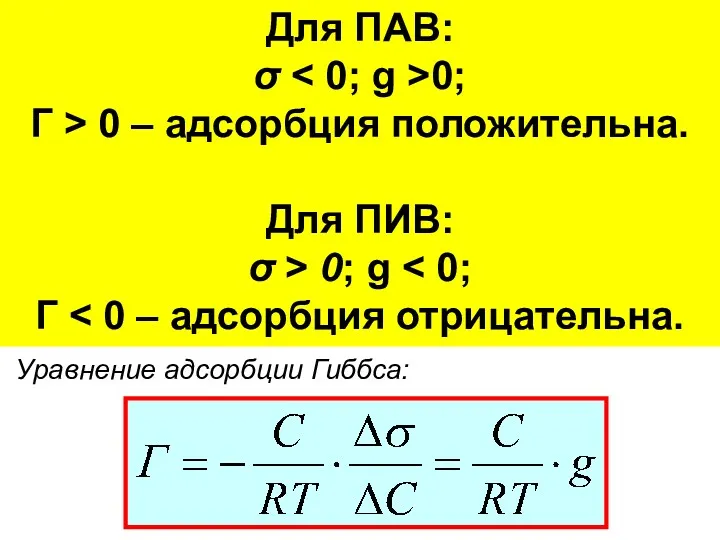
- 21. Изотерма адсорбции Гиббса Уравнение адсорбции Гиббса: Для ПАВ: σ 0; Г > 0 – адсорбция положительна.
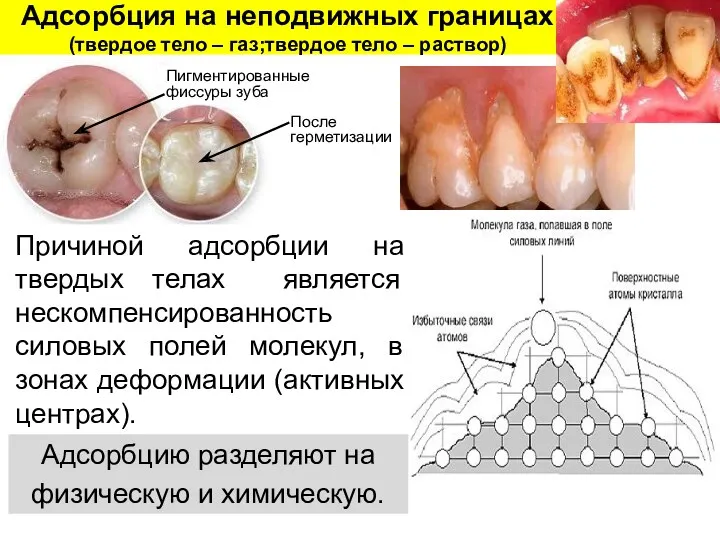
- 22. Адсорбция на неподвижных границах (твердое тело – газ;твердое тело – раствор) Причиной адсорбции на твердых телах
- 23. Физическая адсорбция (ФАд) возникает за счет ван-дер-ваальсовых взаимодействий и происходит на активных центрах (во впадинах поверхности).
- 24. Адсорбция (Г) на подвижной и неподвижной границах раздела описывается уравнением Ленгмюра Г∞ – предельная адсорбция; b
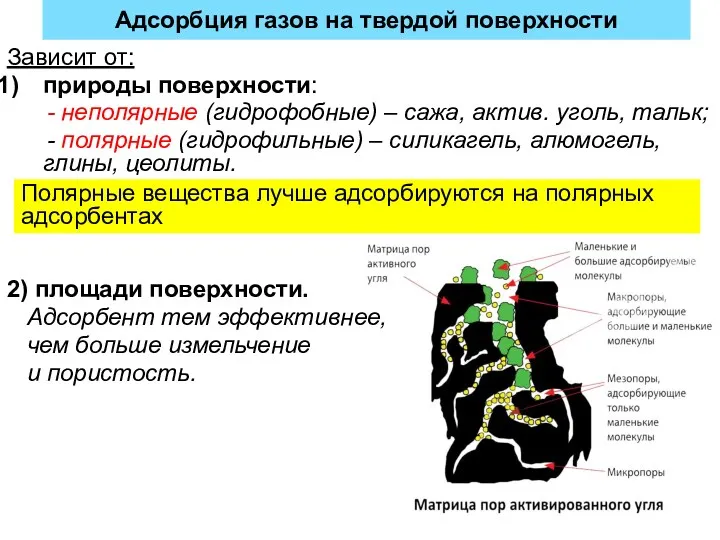
- 25. Адсорбция газов на твердой поверхности Зависит от: природы поверхности: - неполярные (гидрофобные) – сажа, актив. уголь,
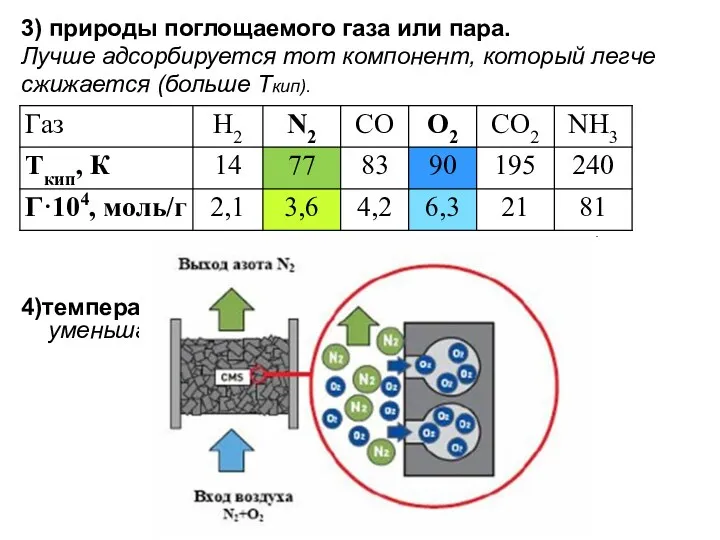
- 26. 3) природы поглощаемого газа или пара. Лучше адсорбируется тот компонент, который легче сжижается (больше Ткип). 4)температуры.
- 27. ИЗОБРЕТЕНИЕ, КОТОРОЕ СПАСЛО ТЫСЯЧИ ЖИЗНЕЙ В 1915 году русский химик-органик, академик АН СССР ЗЕЛИНСКИЙ Н.Д. с
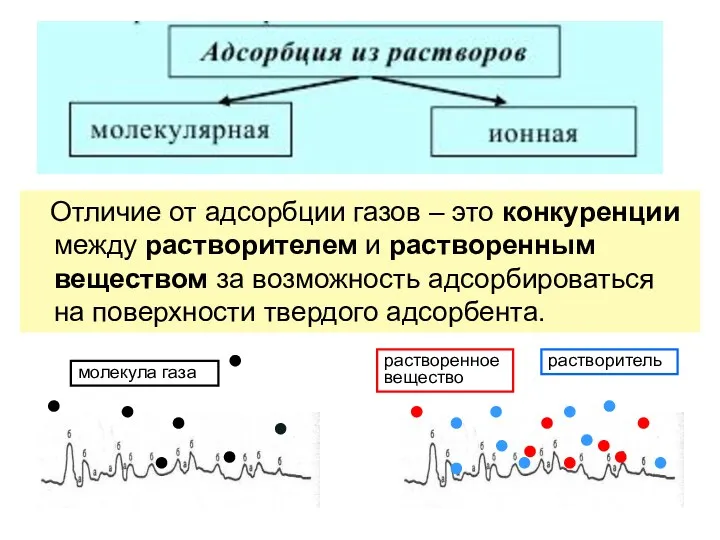
- 28. Отличие от адсорбции газов – это конкуренции между растворителем и растворенным веществом за возможность адсорбироваться на
- 29. Молекулярная (неэлектролитов) адсорбция Зависит от: 1) природы адсорбента. Полярные адсорбенты поглощают полярные вещества. 2) природы растворителя.
- 30. Адсорбция ионов из растворов в зависимости от природы адсорбента подразделяется на ионную адсорбцию и ионнообменную адсорбцию
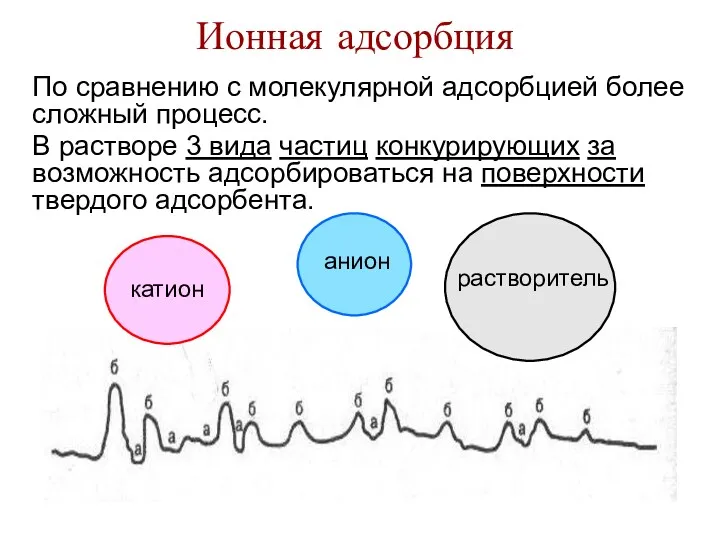
- 31. Ионная адсорбция По сравнению с молекулярной адсорбцией более сложный процесс. В растворе 3 вида частиц конкурирующих
- 32. Зависит от: 1) природы адсорбента. Чем более полярный адсорбент, тем лучше адсорбция ионов. 2) природы иона:
- 33. Избирательная адсорбция ионов правило Панета – Фаянса Например: на AgI могут адсорбироваться Ag+ и I-, а
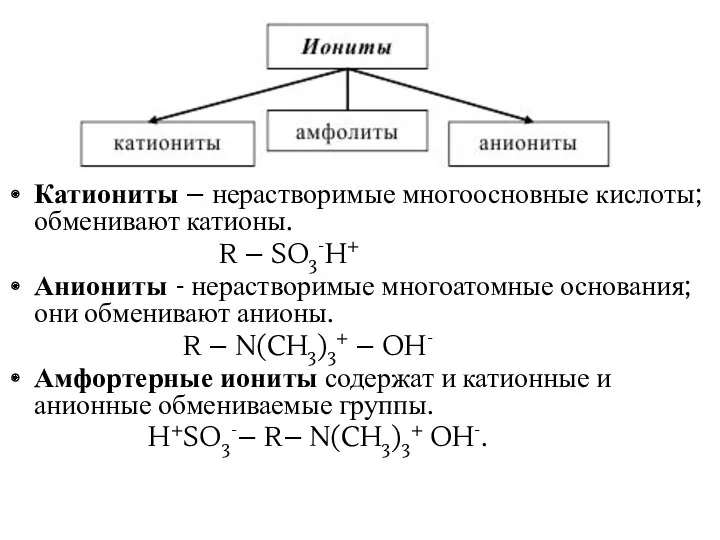
- 34. Ионообменная адсорбция Ионообменная адсорбция – процесс, при котором твердый адсорбент обменивает свои ионы на ионы того
- 35. Катиониты – нерастворимые многоосновные кислоты; обменивают катионы. R – SO3-H+ Аниониты - нерастворимые многоатомные основания; они
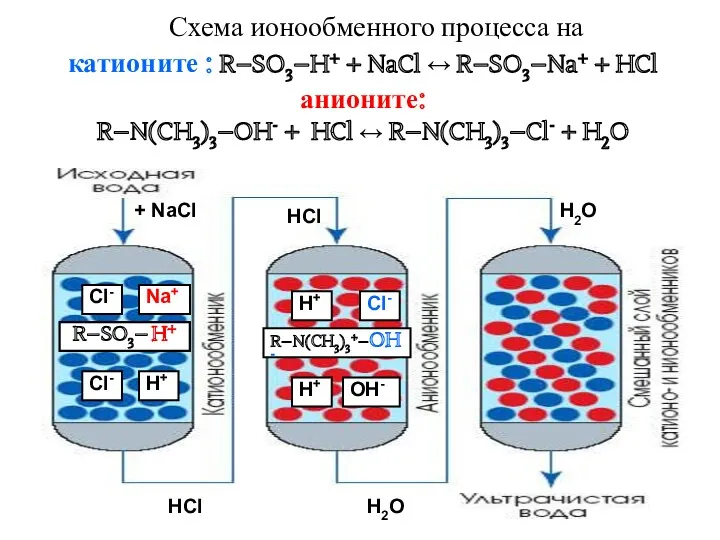
- 36. Схема ионообменного процесса на катионите : R–SO3–H+ + NaCl ↔ R–SO3–Na+ + HCl анионите: R–N(CH3)3–OH- +
- 38. Скачать презентацию












 Применение алюминия и его сплава в машиностроении
Применение алюминия и его сплава в машиностроении Твердые вещества
Твердые вещества Химическая связь. Природа химической связи
Химическая связь. Природа химической связи Типы химических реакций
Типы химических реакций Изомерия биоорганических соединений. Структура и функции биолекул
Изомерия биоорганических соединений. Структура и функции биолекул Химические свойства альдегидов
Химические свойства альдегидов Атомовиты. Анатомо-физиологические свойства
Атомовиты. Анатомо-физиологические свойства Азот қышқылы
Азот қышқылы Хімічні властивості оксидів
Хімічні властивості оксидів Газовые смеси
Газовые смеси Простые вещества неметаллы
Простые вещества неметаллы Лекция №11 ДИСПЕРСНЫЕ СИСТЕМЫ И РАСТВОРЫ
Лекция №11 ДИСПЕРСНЫЕ СИСТЕМЫ И РАСТВОРЫ Хімія та побут
Хімія та побут Пропилен-алкены(пропен)
Пропилен-алкены(пропен) Кремний и его соединения
Кремний и его соединения Учение о растворах
Учение о растворах Жиры. История открытия, строение, классификация, свойства
Жиры. История открытия, строение, классификация, свойства Теория растворов (лекция 2)
Теория растворов (лекция 2) Фосфор красный, белый и черный
Фосфор красный, белый и черный Electronică aplicată. (Curs 2)
Electronică aplicată. (Curs 2) Қанықпаған көмірсутектердің реакцияға түсу қабілеттілігі
Қанықпаған көмірсутектердің реакцияға түсу қабілеттілігі Формула вещества. Относительная молекулярная масса. Простые и сложные вещества (8 класс)
Формула вещества. Относительная молекулярная масса. Простые и сложные вещества (8 класс) Сушка в химической промышленности. Свойства влажного воздуха
Сушка в химической промышленности. Свойства влажного воздуха Основания, их классификация и свойства
Основания, их классификация и свойства Алюминий. Сплавы алюминия
Алюминий. Сплавы алюминия Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Диагностика метаморфических и гидротермальных горных пород
Диагностика метаморфических и гидротермальных горных пород Изомерия и ее виды
Изомерия и ее виды