Содержание
- 2. Кремний в природе Второй после кислорода ¼ состава земной коры Наиболее распространен SiO2 кремнезем (разновидность оксида
- 3. Соединения кремния в природе Агат Аметист Кварц Кремень SiO2
- 4. Силикаты – соли кремниевой кислоты Гранит( наиболее прочная магматическая порода, состоящая в основном из кварца) Глина
- 5. Соединения кремния в природе Глина Песок Халцедон Яшма АЛЮМОСИЛИКАТ Al2O3 ● 2 SiO2 ● 2 H2O
- 6. Соединения кремния в живой природе Дает Прочность стеблям растений Защитные покровы животным Гладкость и прочность костям
- 7. 1. Кремний в ПС 2. Кремний как простое вещество Кристаллический кремний (алмазоподобная структура). Тёмно-серое со стальным
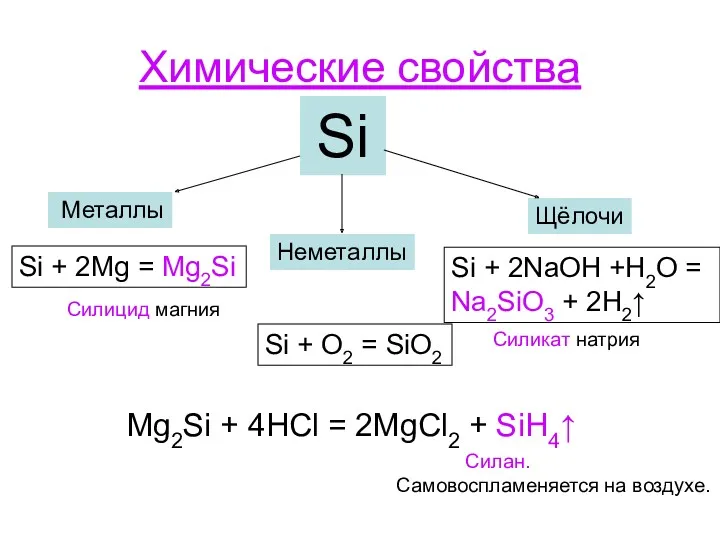
- 8. Химические свойства Si Металлы Неметаллы Щёлочи Si + 2Mg = Mg2Si Силицид магния Si + O2
- 9. Получение кремния Кремний получают восстановлением оксида кремния (IV) углеродом или магнием при нагревании: SiO2 + 2Mg
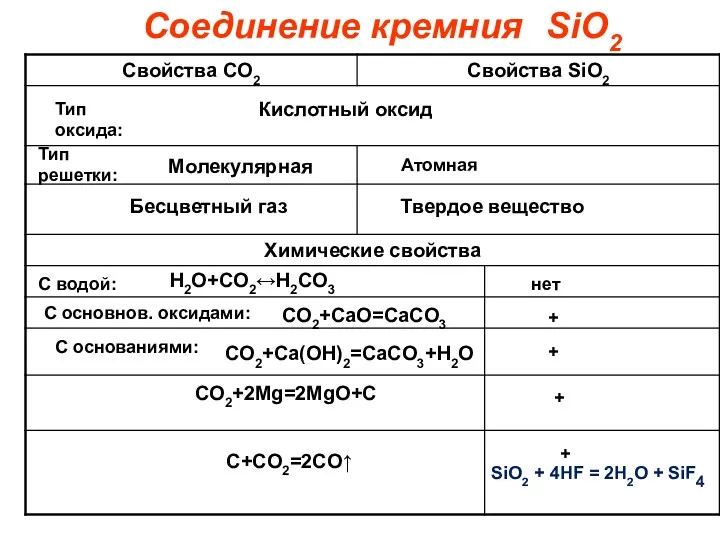
- 10. Соединение кремния Кислотный оксид Молекулярная Атомная Тип оксида: Тип решетки: Бесцветный газ Твердое вещество С водой:
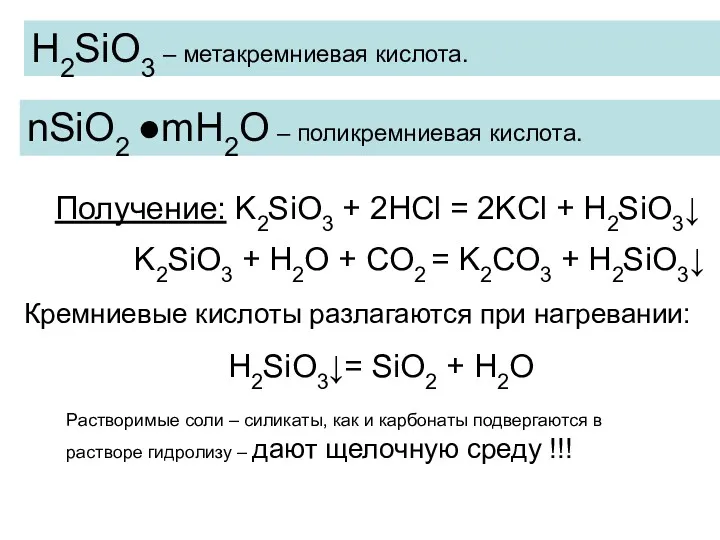
- 11. Получение: K2SiO3 + 2HCl = 2KCl + H2SiO3↓ H2SiO3 – метакремниевая кислота. ●mH2O – поликремниевая кислота.
- 12. Получение кремниевой кислоты Силикатный клей Кремниевая кислота Силикагель
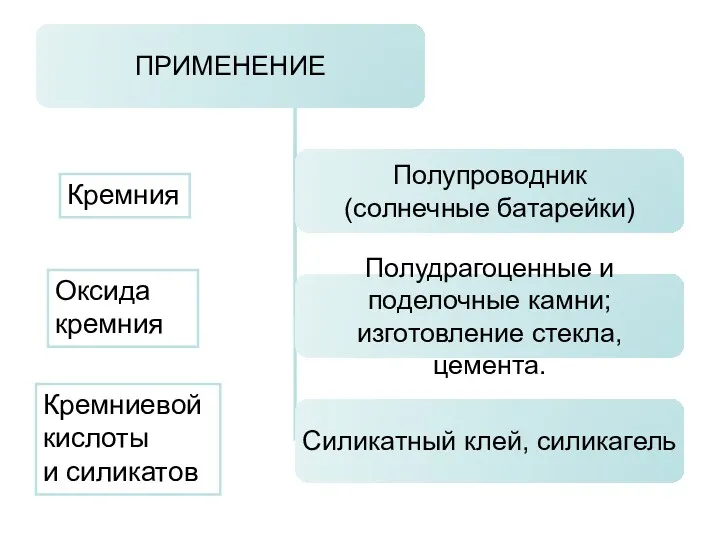
- 13. Кремния Оксида кремния Кремниевой кислоты и силикатов
- 14. это отрасль промышленности, занимающаяся переработкой природных соединений кремния. К ней относится производство фарфора, керамики, фаянса, стекла,
- 15. Стекло - древнейшее изобретение человечества Оконное стекло Кварцевое стекло Хрустальное стекло Цветное стекло Стеклянные изделия Древнего
- 16. Керамика – значит глина, а там тоже кремний Кирпич Керамическая посуда Фарфор Фаянс Статуэтки Отделочная плитка
- 17. Кремний полупроводник Солнечные батарейки Солнечные батареи Фотоэлементы Электроника
- 19. Скачать презентацию












 Непредельные углеводороды
Непредельные углеводороды Разбор заданий #ОВРновый, #реакционно и #соточка
Разбор заданий #ОВРновый, #реакционно и #соточка Проектная деятельность школьников в процессе обучения химии
Проектная деятельность школьников в процессе обучения химии Карбоновые кислоты. Свойства карбоновых кислот
Карбоновые кислоты. Свойства карбоновых кислот Химия углеводов
Химия углеводов Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов Набор № 3 ВС Щелочи
Набор № 3 ВС Щелочи Полиэтилен — [—CH2--CH2—]n ақ түсті термопластикалық полимер
Полиэтилен — [—CH2--CH2—]n ақ түсті термопластикалық полимер Реакции деструкции макромолекул
Реакции деструкции макромолекул Классификация химических реакций
Классификация химических реакций Химическая кинетика. Закон действующих масс для скорости реакции
Химическая кинетика. Закон действующих масс для скорости реакции Закон сохранения массы веществ
Закон сохранения массы веществ Негізгі топша элементтерінің химиясы
Негізгі топша элементтерінің химиясы Альдегиды и кетоны
Альдегиды и кетоны Процессы и операции формообразования. Металлургия цветных металлов
Процессы и операции формообразования. Металлургия цветных металлов Химия и косметика
Химия и косметика Соляная кислота (HCI)
Соляная кислота (HCI) Нанотехнологии в школьном образовании. Семинар учителей химии
Нанотехнологии в школьном образовании. Семинар учителей химии История открытия фосфора
История открытия фосфора Нуклеиновые кислоты
Нуклеиновые кислоты Генетическая связь неорганических соединений (8 класс)
Генетическая связь неорганических соединений (8 класс)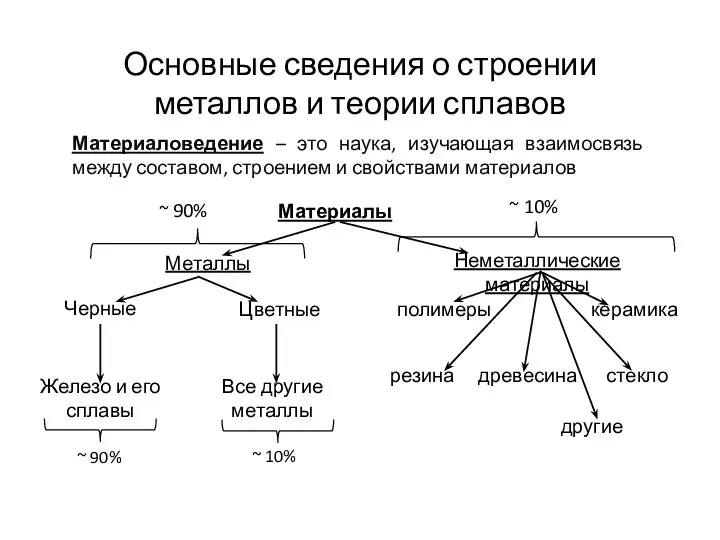 Основные сведения о строении металлов и теории сплавов
Основные сведения о строении металлов и теории сплавов Фенолы+
Фенолы+ Аналитическая химия
Аналитическая химия Торий. Алынуы
Торий. Алынуы Электролиз расплавов и водных растворов солей
Электролиз расплавов и водных растворов солей Гибридизация атомных орбиталей
Гибридизация атомных орбиталей Химическая термодинамика
Химическая термодинамика