Содержание
- 2. Гомогенные реакции N2(г) + O2(г) = 2NO(г) Гетерогенные реакции Zn(тв) + 2HCl(ж) = ZnCl2(ж) + Н2(г)
- 3. Скорость химической реакции – это изменение концентраций реагентов или продуктов реакций в единицу времени. Для реакции:
- 4. ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ: природа реагирующих веществ, их концентрации, характер реакции (гомогенная или гетерогенная
- 5. Влияние природы реагирующих веществ NaCl + AgNO3 = AgCl↓ + NaNO3 Cl– + Ag+ = AgCl↓
- 6. Зависимость скорости реакции от концентрации. З-н действия масс (1867, Гильдберг, Вааге) nА + mВ → cС
- 7. Примеры. V = k[A]n[В]m Fe2O3 (к) + 3H2 (г) = 2Fe + 3H2O (г) V =
- 8. Зависимость скорости реакции от температуры Правило Вант-Гоффа Vt1 и Vt2 – скорость реакции при температуре t1
- 9. Пример. Во сколько раз увеличится скорость химической реакции при повышении температуры от 10 до 40оС, если
- 10. Теория активации Аррениуса Н2 + I2 ⇄ 2HI H I H … I H − I
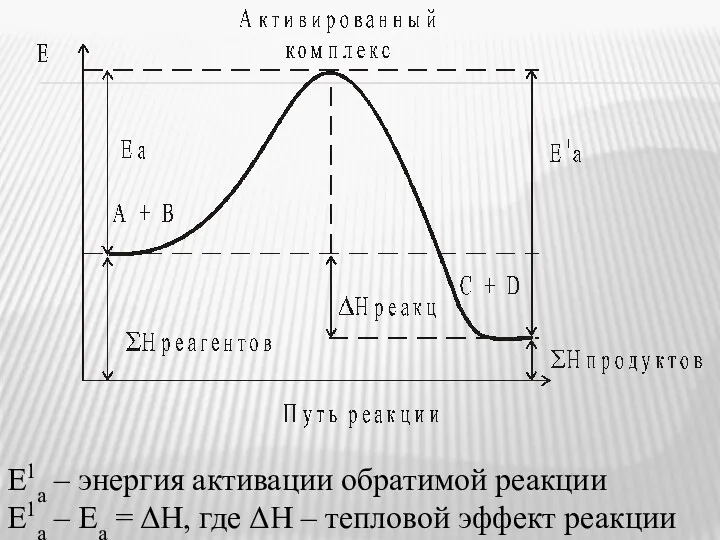
- 11. Е1а – энергия активации обратимой реакции Е1а – Еа = ΔН, где ΔН – тепловой эффект
- 12. А – постоянный множитель, не зависящий от температуры; Еа – энергия активации; R – универсальная газовая
- 13. гомогенный катализ гетерогенный катализ 2H2O2 Влияние катализатора на скорость химической реакции 2H2O + O2
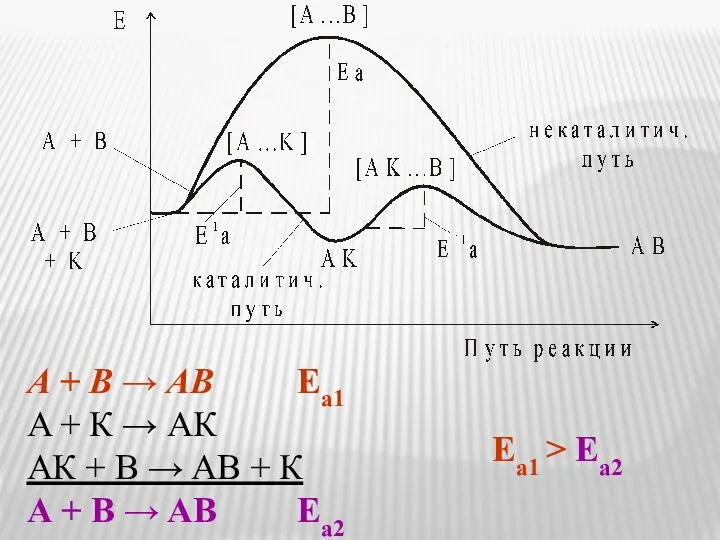
- 14. А + B → AB Еа1 A + К → AК AК + B → AB
- 15. 0,5O2 + NO = NO2 NO2 + SO2 = SO3 + NO Пример. SO2 + 0,5O2
- 16. Механизм химических реакций простые (молекулярные) реакции Еа = 120 – 440 кДж/моль Одномолекулярная (мономолекулярная) СаСО3 →
- 17. ионные реакции Cl– + Ag+ = AgCl↓ Еакт = 0 – 80 кДж/моль
- 18. радикальные (цепные) реакции
- 19. Химическое равновесие 3H2 + N2 ⇄ 2NH3 CO+H2 ⇄CO2+H2O → прямая реакция ← обратная реакция Обратимые
- 20. аА + вВ сС + dD = [A]a [B]b = [C]c [D]d В условиях равновесия (помнить,
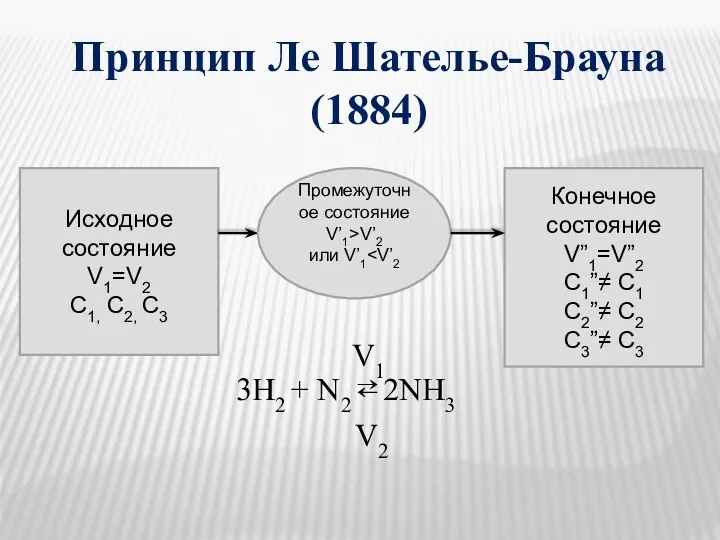
- 22. Принцип Ле Шателье-Брауна (1884) Исходное состояние V1=V2 C1, С2, С3 Промежуточное состояние V’1>V’2 или V’1 3H2
- 23. Влияние концентрации оксихлорид висмута +H2O равновесие смещается → (образуется BiOCl) 2) +HCl смещение равновесия ← (образуется
- 24. Для прямой экзотермической реакции ΔHо При ↑ t равновесие смещается ← При ↓ t смещение равновесия
- 25. Для прямой эндотермической реакций ΔHо > 0 При ↑ t смещение равновесия → При ↓ t
- 26. Влияние давления 3H2(г) + N2(г) ⇄2NH3(г) 4 моля газа 2 моля газа При ↑ P смещение
- 27. СаСО3(к) ⇄ СаО(к) + СО2(г) = Р равновесие смещается → ↑ Р [СО2] смещение равновесия ←
- 28. Пример. В каком направлении должно смещаться равновесие реакции: N2O4 (г) 2NO2 (г), При: а) добавлении N2O4;
- 30. Скачать презентацию





![Примеры. V = k[A]n[В]m Fe2O3 (к) + 3H2 (г) =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/178091/slide-6.jpg)










![аА + вВ сС + dD = [A]a [B]b =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/178091/slide-19.jpg)
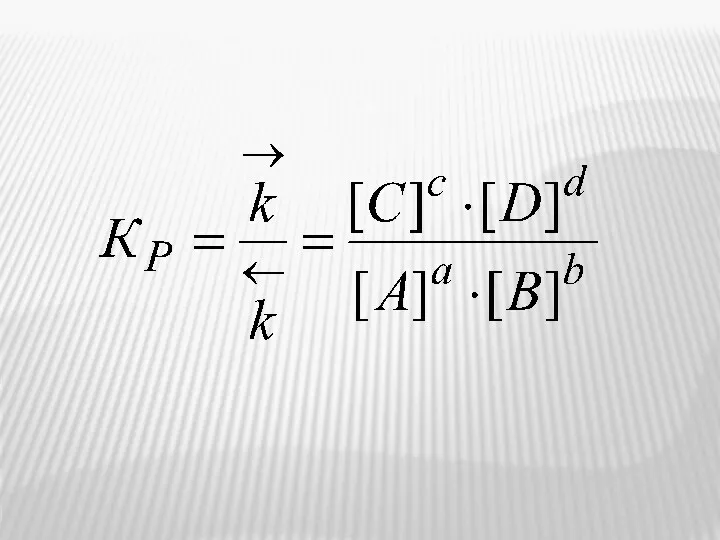




![СаСО3(к) ⇄ СаО(к) + СО2(г) = Р равновесие смещается → ↑ Р [СО2] смещение равновесия ←](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/178091/slide-26.jpg)

 Строение атома. Лекция № 2
Строение атома. Лекция № 2 Молекулярно-массовые характеристики высокомолекулярных соединений
Молекулярно-массовые характеристики высокомолекулярных соединений Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Горные породы Крыма
Горные породы Крыма Материаловедение. Силикатные материалы
Материаловедение. Силикатные материалы Аммиак. Соли аммония
Аммиак. Соли аммония Cкорость химической реакции
Cкорость химической реакции Карбоновые кислоты
Карбоновые кислоты Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Химическое равновесие
Химическое равновесие Средства гигиены
Средства гигиены Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар
Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар Железо и его свойства
Железо и его свойства Физические свойства минералов
Физические свойства минералов Кислородсодержащие органические соединения. Лабораторная работа
Кислородсодержащие органические соединения. Лабораторная работа Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве
Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве Кислоты. Растворы всех кислот
Кислоты. Растворы всех кислот Атом. Будова атома
Атом. Будова атома Анализ технологии производства с использованием принципов Зеленой химии
Анализ технологии производства с использованием принципов Зеленой химии Электрохимические методы. Кондуктометрия в анализе объектов окружающей среды
Электрохимические методы. Кондуктометрия в анализе объектов окружающей среды Алкадиены. Актуализация ранее полученных знаний
Алкадиены. Актуализация ранее полученных знаний Металлы побочных подгрупп
Металлы побочных подгрупп Свойства жидких металлов
Свойства жидких металлов Общее понятие напряженно – деформированного состояния деталей машин из металлических материалов, применяемых в машиностроении
Общее понятие напряженно – деформированного состояния деталей машин из металлических материалов, применяемых в машиностроении Аналітична хімія. Лекція 1
Аналітична хімія. Лекція 1 Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) Ионоселективные электроды
Ионоселективные электроды Экскурсия по химическому факультету
Экскурсия по химическому факультету