Содержание
- 2. Составитель: К.т.н., доцент Габдуллин Альфред Нафитович
- 3. Основные понятия Комплексные (координационные) соединения (КС) состоят из центрального атома или иона металла (d- и f-металлы,
- 4. Координационное число (К.Ч.) ─ количество лигандов, связанных с центральным атомом во внутренней сфере (К.Ч. = 1─12).
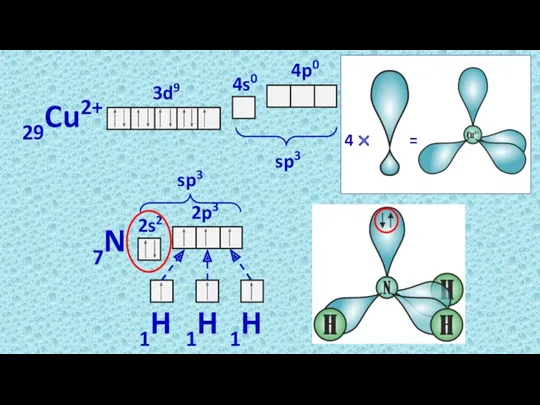
- 5. Природа связи в координационных соединениях КС образуются благодаря донорно-акцепторным связям. Лиганд ─ донор электронных пар. Это
- 7. Имеет плоскую форму из-за наличия неспаренного электрона.
- 8. Номенклатура Традиционные названия: [Pt(NH3)4][PtCl4] – соль Магнуса K3[Fe(CN)6] – красная кровяная соль цис-[Pt(NH3)2Cl2] – соль Пейроне
- 9. В зависимости от природы лигандов различают: Аквакомплексы: [Cu(H2O)5]SO4, [Cr(H2O)6]Cl3 и т.д.; Амминокомплексы: [Cu(NH3)2]Cl, [Zn(NH3)4]Cl2 и т.д.;
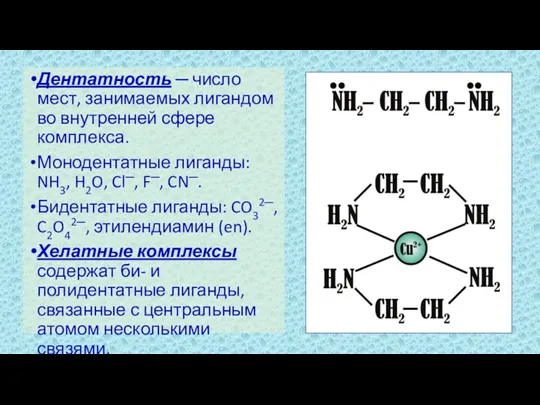
- 10. Дентатность ─ число мест, занимаемых лигандом во внутренней сфере комплекса. Монодентатные лиганды: NH3, H2O, Cl─, F─,
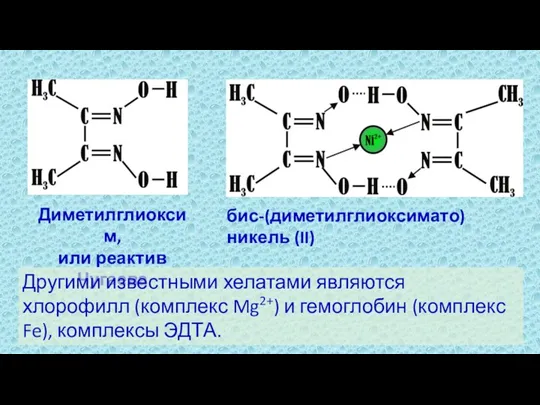
- 11. Диметилглиоксим, или реактив Чугаева бис-(диметилглиоксимато)никель (II) Другими известными хелатами являются хлорофилл (комплекс Mg2+) и гемоглобин (комплекс
- 12. Диссоциация комплексов. Константа нестойкости Первичная диссоциация [Co(NH3)6]Cl2 = [Co(NH3)6]2+ + 2Cl─ Вторичная диссоциация [Co(NH3)6]2+ ⮀ [Co(NH3)5]2+
- 14. Реакции с участием комплексных соединений [Cr(H2O)6]3+ ⮀ [Cr(H2O)5(OH)]2+ ⮀ ⮀ [Cr(H2O)4(OH)2]+ ⮀ [Cr(H2O)3(OH)3] ⮀ ⮀ [Cr(H2O)2(OH)4]─
- 15. Реакции с участием комплексных соединений [Fe(H2O)6]3+ + 4SCN─ ⇄ [Fe (H2O)2(SCN)4]─ CuO + 4NH4OH(конц.) = [Cu(NH3)4](OH)2
- 16. Реакции с участием комплексных соединений 3. Разрушение комплексов Связывание иона комплексообразователя K2[HgI4] + K2S = HgS
- 18. Скачать презентацию





![Номенклатура Традиционные названия: [Pt(NH3)4][PtCl4] – соль Магнуса K3[Fe(CN)6] – красная](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265847/slide-7.jpg)
![В зависимости от природы лигандов различают: Аквакомплексы: [Cu(H2O)5]SO4, [Cr(H2O)6]Cl3 и](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265847/slide-8.jpg)
![Диссоциация комплексов. Константа нестойкости Первичная диссоциация [Co(NH3)6]Cl2 = [Co(NH3)6]2+ +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265847/slide-11.jpg)

![Реакции с участием комплексных соединений [Cr(H2O)6]3+ ⮀ [Cr(H2O)5(OH)]2+ ⮀ ⮀](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265847/slide-13.jpg)
![Реакции с участием комплексных соединений [Fe(H2O)6]3+ + 4SCN─ ⇄ [Fe](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265847/slide-14.jpg)

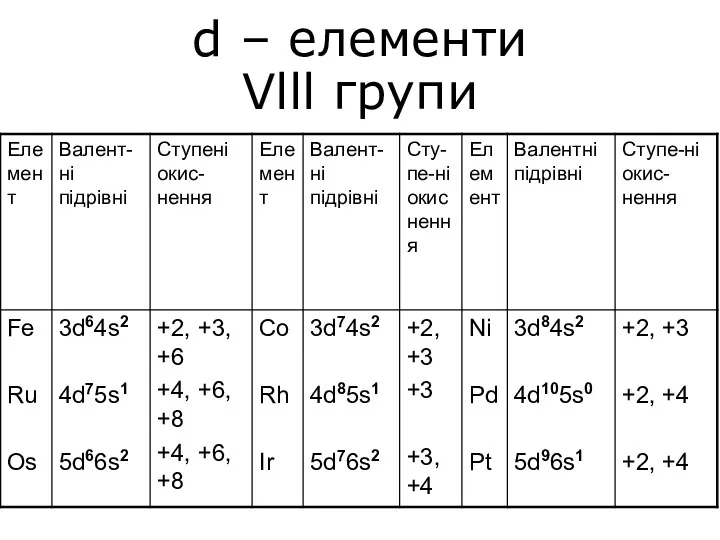 d – елементи Vlll групи
d – елементи Vlll групи Неизотермический процесс в химическом реакторе. Лекция 8
Неизотермический процесс в химическом реакторе. Лекция 8 Пластмассы в автомобилестроении
Пластмассы в автомобилестроении Важнейшие минералы
Важнейшие минералы Застосування алканів
Застосування алканів Атом. Модели строения атома
Атом. Модели строения атома Крахмал. Физические свойства
Крахмал. Физические свойства Склад і властивості нафти
Склад і властивості нафти Циклоалканы
Циклоалканы Простые вещества неметаллы
Простые вещества неметаллы Основы химической термодинамики (лекция 6)
Основы химической термодинамики (лекция 6) Растворимость малорастворимого сильного электролита
Растворимость малорастворимого сильного электролита Хлор
Хлор Кристалічний і аморфний стани твердих речовин
Кристалічний і аморфний стани твердих речовин Свойства жидкостей
Свойства жидкостей Карбоновые кислоты и их гетерофункциональные производные
Карбоновые кислоты и их гетерофункциональные производные Подгруппа углерода
Подгруппа углерода Природный газ
Природный газ Олимпиада по учебной дисциплине. Химия
Олимпиада по учебной дисциплине. Химия Кристаллическое строение и свойства металлов
Кристаллическое строение и свойства металлов Энергетика химических процессов. Энтропия и энергия Гиббса
Энергетика химических процессов. Энтропия и энергия Гиббса Электростатические взаимодействия, как фактор, определяющий структуру и реакционную способность органических соединений
Электростатические взаимодействия, как фактор, определяющий структуру и реакционную способность органических соединений Современные химические технологии
Современные химические технологии Свойства растворов высокомолекулярных соединений
Свойства растворов высокомолекулярных соединений Конструкционные функциональные волокнистые композиты. Углеродные волокна
Конструкционные функциональные волокнистые композиты. Углеродные волокна Классификация и свойства оксидов
Классификация и свойства оксидов Електроліз. Найпоширеніші способи застосування
Електроліз. Найпоширеніші способи застосування Алкани, насичені вуглеводні
Алкани, насичені вуглеводні