Содержание
- 2. Тема урока: «Простые вещества – неметаллы. Аллотропия»
- 3. Цели урока: Получить представление о простых веществах – неметаллах; Познакомиться с общими физическими свойствами неметаллов и
- 4. Проверка домашнего задания. 1. Где в периодической системе находятся элементы, соответствующие простым веществам металлам?
- 5. 2. Каковы общие физические свойства металлов?
- 6. 3. По каким физическим свойствам различаются металлы?
- 7. 4. Какое из веществ названных в приведённом ниже стихотворении, не относится к металлам? Семь металлов создал
- 8. Изучение новой темы. «Простые вещества – неметаллы. Аллотропия»
- 9. Неметаллы - это химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими свойствами
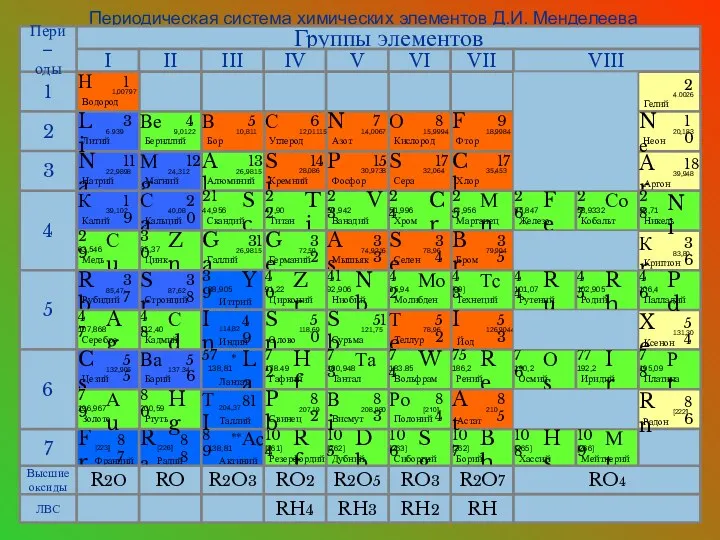
- 10. Периодическая система химических элементов Д.И. Менделеева
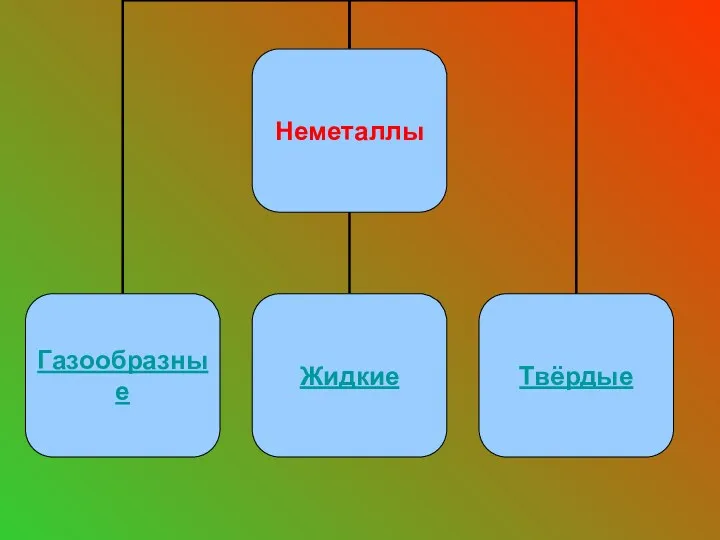
- 12. Газообразные вещества неметаллы: О2 - N2 - H2 - Cl2 - F2 -
- 13. N2 Cl2 F2 В начало
- 14. благородные газы: He - Ne - Ar - Kr - Xe - Rn - Инертные газы
- 15. Строение внешнего электронного слоя атомов гелия и неона +2 He ) 2 +10 Ne ) )
- 16. Применение гелия, неона и аргона.
- 17. Единственное жидкое вещество - Br2.
- 18. Твердые вещества: S – P – I2 – C – Si -
- 19. Аллотропия – способность атомов одного химического элемента образовывать несколько простых веществ. Причины аллотропии: Различное число атомов
- 20. Аллотропия кислорода. Кислород и озон
- 21. Модификации кислорода. О2- кислород; бесцветный газ; не имеет запаха; плохо растворим в воде; температура кипения-182,9 С;
- 22. Аллотропия фосфора. Красный и белый фосфор Р (красный фосфор) (белый фосфор) Р4
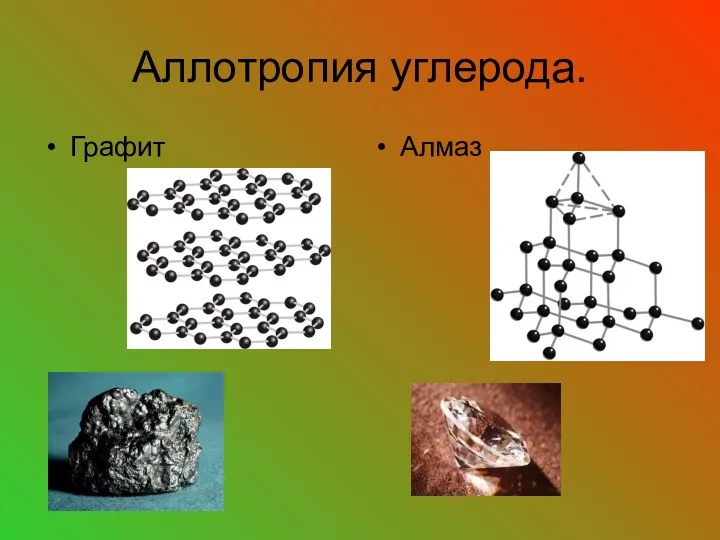
- 23. Аллотропия углерода. Графит Алмаз
- 24. Аллотропия серы. Кристаллическая, пластическая и моноклинная
- 25. Пограничное положение между металлами и неметаллами. Белое олово металл Серое олово неметалл
- 26. Почему химически неверно поэтическое выражение: «В воздухе пахло грозой»?
- 27. Экспедиция полярного исследователя Р. Скотта к Южному полюсу в 1912 году погибла из-за того, что потеряла
- 28. Какой тип химической связи должен быть в металлическом водороде?
- 29. Выполните задание. 1 вариант О2 – кислород, газ; Р4 – I2 – Si – бетта Sn
- 30. Проверь ответы. 1 вариант О2 – кислород, газ; Р4 – белый фосфор,твёрдый; I2 – йод, твердый
- 31. Критерии оценок 8 правильных ответов – «5»; 7,6 првильных ответов – «4»; 5,4 правильных ответов –
- 33. Скачать презентацию



























 Гетероциклдық қосылыстардың туындылары
Гетероциклдық қосылыстардың туындылары Непредельные углеводороды этиленового ряда (олефины, алкены)
Непредельные углеводороды этиленового ряда (олефины, алкены) План характеристики елемента за його положенням у періодичній системі та будовою атома
План характеристики елемента за його положенням у періодичній системі та будовою атома Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Biomass Feedstocks
Biomass Feedstocks Химическая взрывчатка
Химическая взрывчатка Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода
Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода Оксиды, их классификация и свойства (8 класс)
Оксиды, их классификация и свойства (8 класс) Практическая работа. Химический состав клетки
Практическая работа. Химический состав клетки Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Закон Авогадро. Молярный объём газов
Закон Авогадро. Молярный объём газов Значення хімії у повсякденному житті
Значення хімії у повсякденному житті Пегматитовые месторождения
Пегматитовые месторождения Строение, свойства и функции белков
Строение, свойства и функции белков Спирты. Виды спирта
Спирты. Виды спирта Геохимические барьеры
Геохимические барьеры Классификация органических соединений
Классификация органических соединений Азотсодержащие соединения
Азотсодержащие соединения Ковалентний зв’язок. Донорно - акцепторний механізм утворення ковалентного зв'язку
Ковалентний зв’язок. Донорно - акцепторний механізм утворення ковалентного зв'язку Водород. Химический знак - H
Водород. Химический знак - H Проект: жило-было мыло
Проект: жило-было мыло Электрохимический ряд напряжений металлов. Свойства металлов
Электрохимический ряд напряжений металлов. Свойства металлов Магний и кальций
Магний и кальций Водород. Нахождение в природе. Физические и химические свойства. Применение
Водород. Нахождение в природе. Физические и химические свойства. Применение Синтетичні високомолекулярні речовини і полімерні матеріали на їх основі
Синтетичні високомолекулярні речовини і полімерні матеріали на їх основі Группа веществ, изолируемых из биологического материала дистилляцией
Группа веществ, изолируемых из биологического материала дистилляцией Количество вещества. 8 класс
Количество вещества. 8 класс Железоуглеродистые сплавы
Железоуглеродистые сплавы