Верны ли следующие суждения о хлоре?
1 вариант
1.Высшая степень окисления +7.
2.В
промышленности хлор полу-
чают из соляной кислоты.
3.Бесцветный газ с резким
запахом.
4.Является сильным окислителем.
5.В хлорной воде обесцвечивают-
ся многие красители.
6.Хлор взаимодействует с
фторидом натрия.
●▲▲●●▲
2 вариант
1.Хлор про являет только
окислительные свойства.
2.В природе встречается в виде
хлоридов.
3.Токсичен для всего живого.
4.Хлор принадлежит к наиболее
активным веществам.
5.В соединениях с неметаллами
проявляет степень окисления -1.
6.Многие металлы сгорают в
хлоре с образованием солей.
▲●●●▲●





 Готовимся к экзамену по химии
Готовимся к экзамену по химии Катализ. Факторы, влияющие на скорость реакции
Катализ. Факторы, влияющие на скорость реакции Химические уравнения Закон сохранения массы веществ
Химические уравнения Закон сохранения массы веществ Реакции ионного обмена
Реакции ионного обмена Гірські породи
Гірські породи Синтез высокомолекулярных соединений
Синтез высокомолекулярных соединений Физико-химические методы анализа. Лекция 3
Физико-химические методы анализа. Лекция 3 Физико-химические методы в анализе ЛВ. Метод ионометрии в анализе ЛВ. Определение спирта в фармацевтических препаратах
Физико-химические методы в анализе ЛВ. Метод ионометрии в анализе ЛВ. Определение спирта в фармацевтических препаратах Галогены
Галогены Химическая промышленность
Химическая промышленность Рафинирование от растворимых окислов
Рафинирование от растворимых окислов Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов
Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов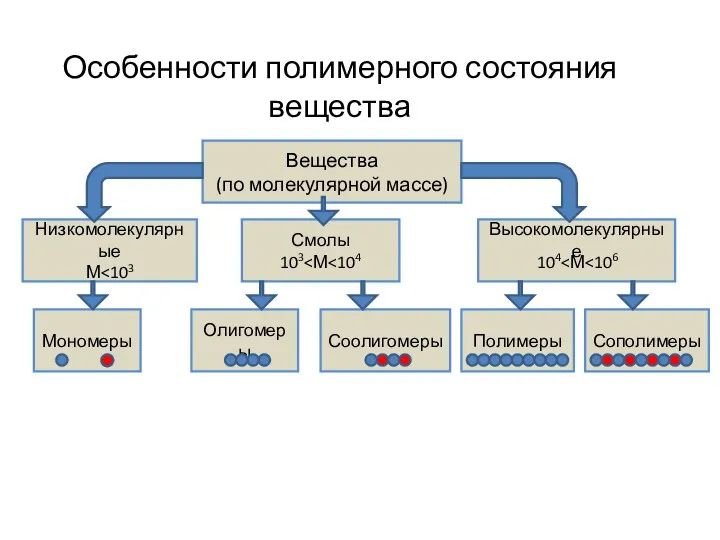 Особенности полимерного состояния вещества
Особенности полимерного состояния вещества Анионактивті беттік активті заттар
Анионактивті беттік активті заттар Гетерогенді химиялық реакциялар
Гетерогенді химиялық реакциялар Азотсодержащие органические соединения. Лекция 8
Азотсодержащие органические соединения. Лекция 8 Экскурсия по химическому факультету
Экскурсия по химическому факультету Реконструкция установки получения элементарной серы
Реконструкция установки получения элементарной серы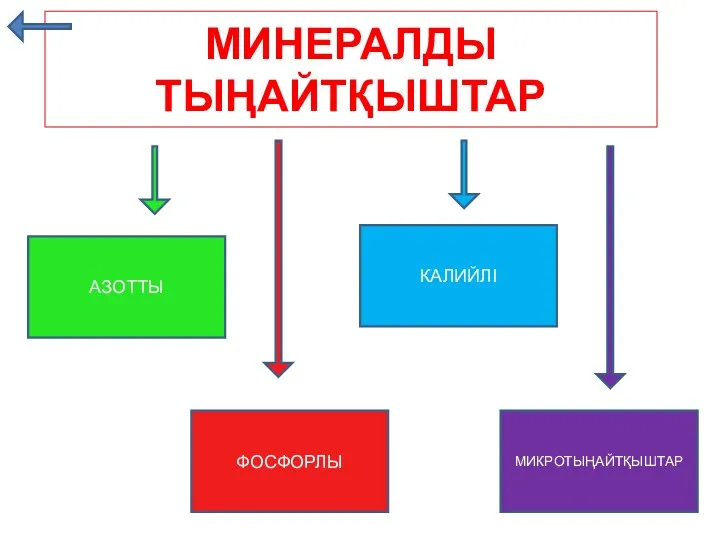 Минералды тыңайтқыштар
Минералды тыңайтқыштар 20230205_metally_pobochnyh_podgrupp
20230205_metally_pobochnyh_podgrupp Анализ качества лекарственных веществ, определяемых методом комплексонометрии
Анализ качества лекарственных веществ, определяемых методом комплексонометрии Производные хинолина и хинуклидина, производные 4-замещенных хинолина
Производные хинолина и хинуклидина, производные 4-замещенных хинолина Адсорбция
Адсорбция Phosphorus and its compounds
Phosphorus and its compounds Получение и применение альдегидов
Получение и применение альдегидов Электролитическая диссоциация
Электролитическая диссоциация Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування
Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування