Содержание
- 2. Предмет органической химии Органическая химия – это химия соединений углерода с другими элементами (Ф.А. Кекуле, середина
- 3. Причины выделения органической химии в отдельную науку четырехвалентность атома углерода; способность атомов углерода образовывать длинные цепи
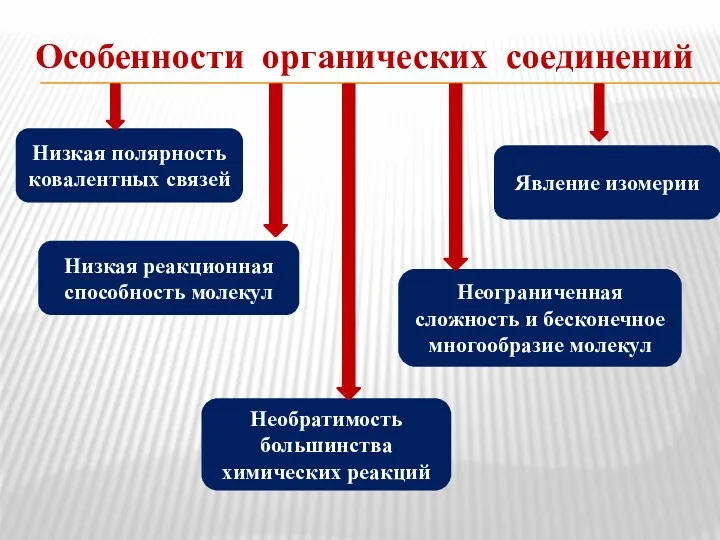
- 4. Особенности органических соединений Неограниченная сложность и бесконечное многообразие молекул Низкая полярность ковалентных связей Явление изомерии Низкая
- 5. Основные положения теории химического строения органических соединений А.М. Бутлерова Атомы в молекулах органических соединений связаны друг
- 6. Изомерия органических соединений Изомеры - это соединения, имеющие одинаковый состав, но отличающиеся последовательностью соединения атомов в
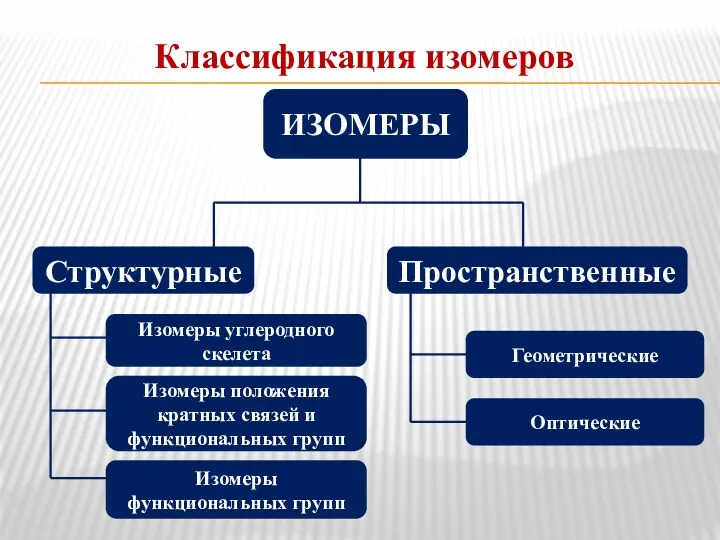
- 7. Классификация изомеров ИЗОМЕРЫ Структурные Пространственные Изомеры углеродного скелета Изомеры положения кратных связей и функциональных групп Изомеры
- 8. Признаки классификации органических соединений Строение углеродного скелета молекулы; Наличие в молекуле функциональных групп.
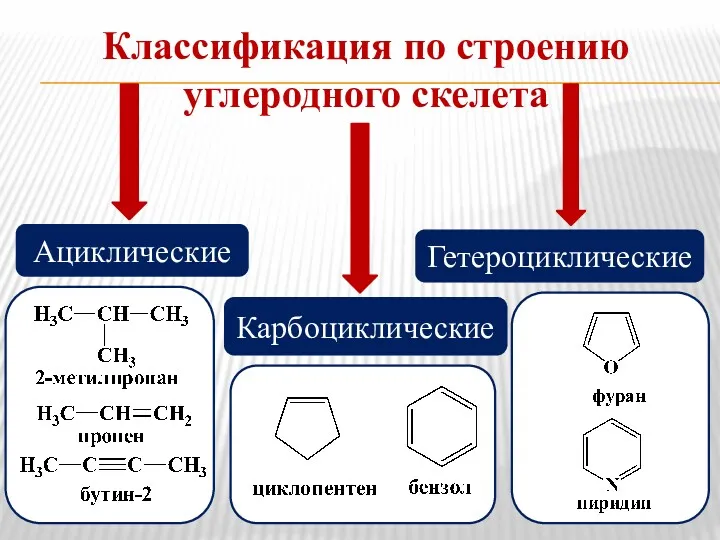
- 9. Классификация по строению углеродного скелета Ациклические Гетероциклические Карбоциклические
- 10. Функциональная группа – это атом или группа атомов, определяющие химические свойства соединения и принадлежность его к
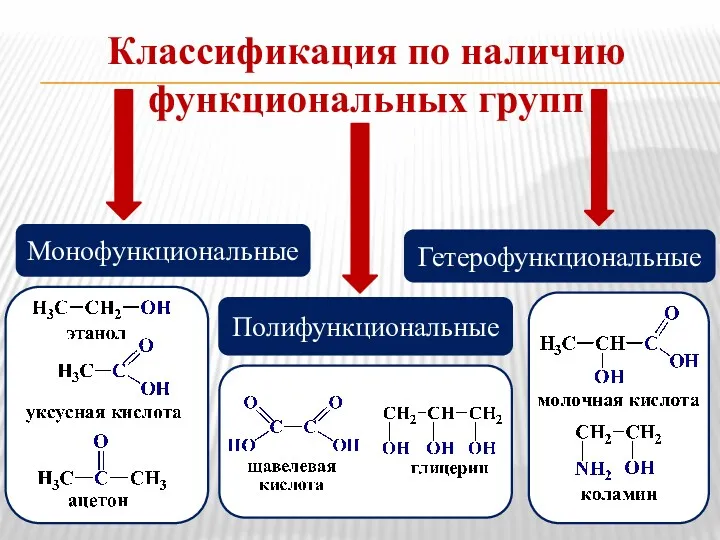
- 11. Классификация по наличию функциональных групп Монофункциональные Гетерофункциональные Полифункциональные
- 12. Номенклатура органических соединений Номенклатура – это система терминов, обозначающих строение веществ и пространственное расположение атомов в
- 13. Химические связи и взаимное влияние атомов в органических соединениях
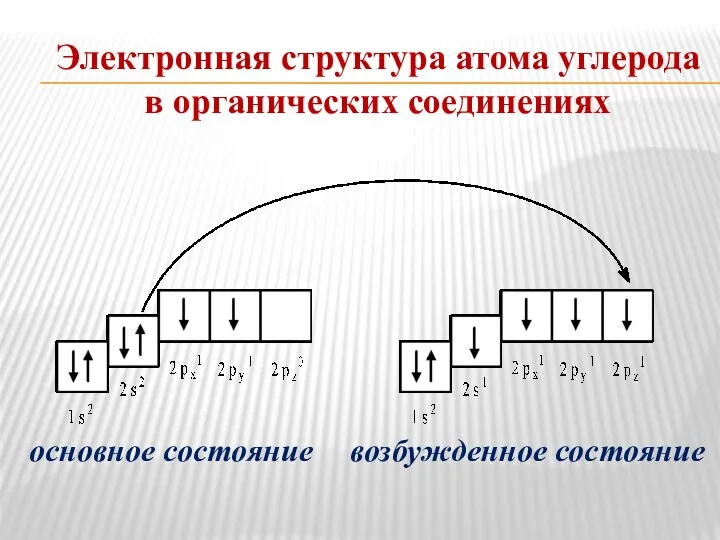
- 14. Электронная структура атома углерода в органических соединениях основное состояние возбужденное состояние
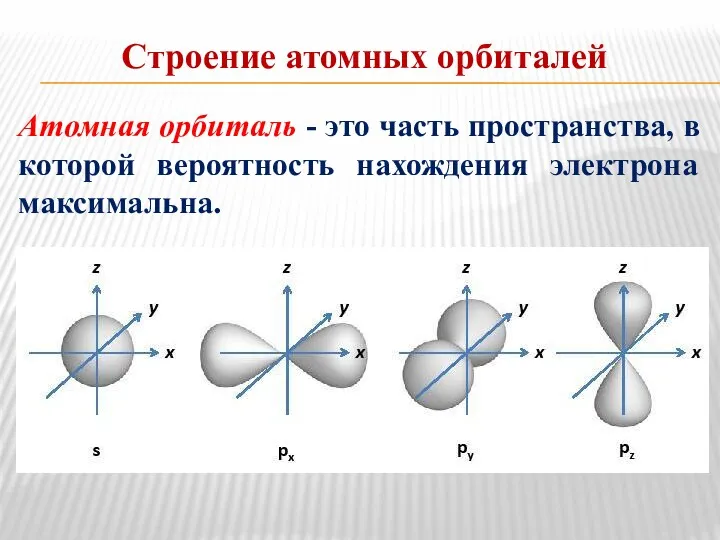
- 15. Строение атомных орбиталей Атомная орбиталь - это часть пространства, в которой вероятность нахождения электрона максимальна.
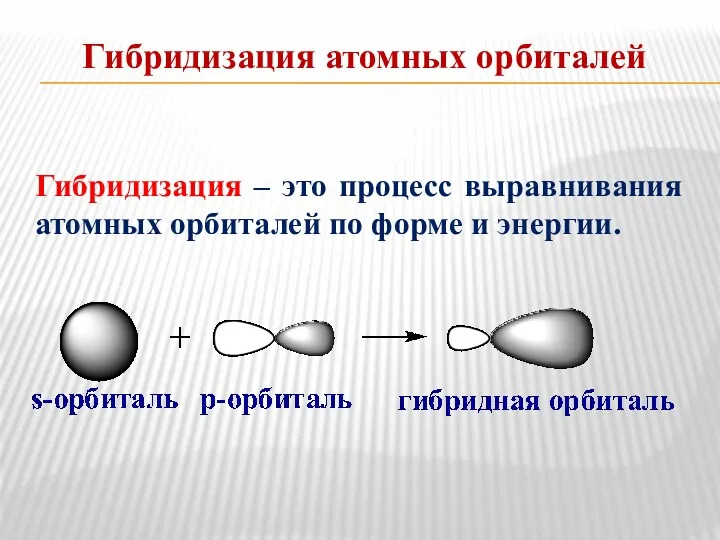
- 16. Гибридизация атомных орбиталей Гибридизация – это процесс выравнивания атомных орбиталей по форме и энергии.
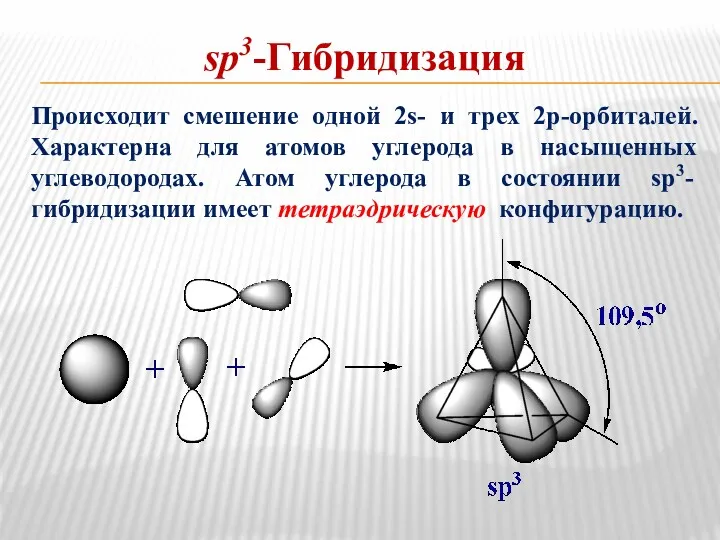
- 17. sp3-Гибридизация Происходит смешение одной 2s- и трех 2р-орбиталей. Характерна для атомов углерода в насыщенных углеводородах. Атом
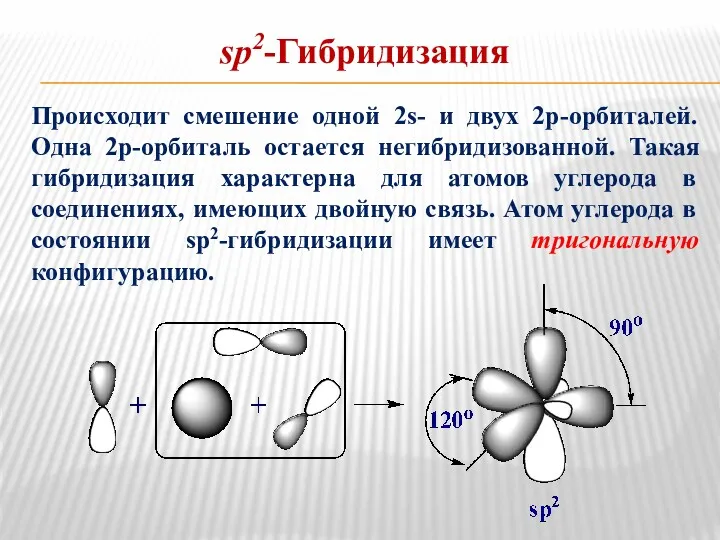
- 18. sp2-Гибридизация Происходит смешение одной 2s- и двух 2р-орбиталей. Одна 2р-орбиталь остается негибридизованной. Такая гибридизация характерна для
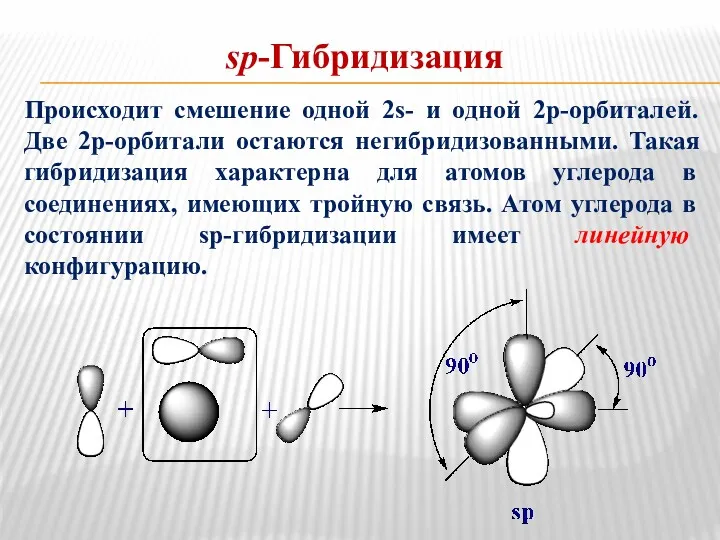
- 19. sp-Гибридизация Происходит смешение одной 2s- и одной 2р-орбиталей. Две 2р-орбитали остаются негибридизованными. Такая гибридизация характерна для
- 20. Химическая связь в органических молекулах В органических соединениях преимущественно встречаются ковалентные связи – химические связи, образованные
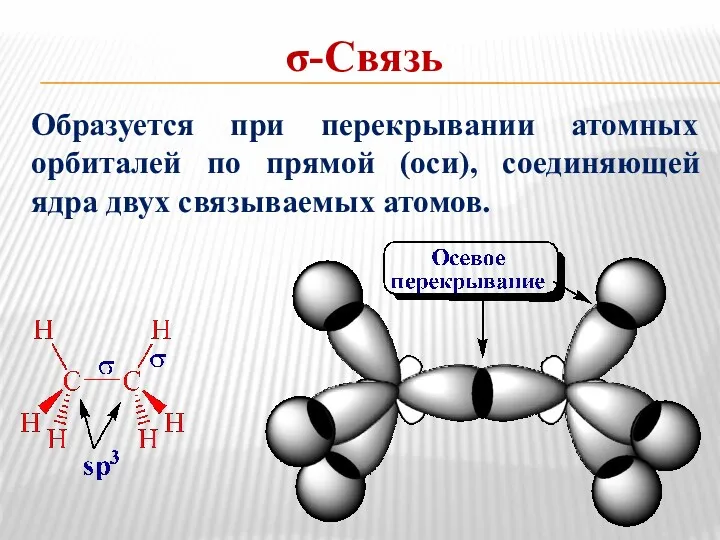
- 21. σ-Связь Образуется при перекрывании атомных орбиталей по прямой (оси), соединяющей ядра двух связываемых атомов.
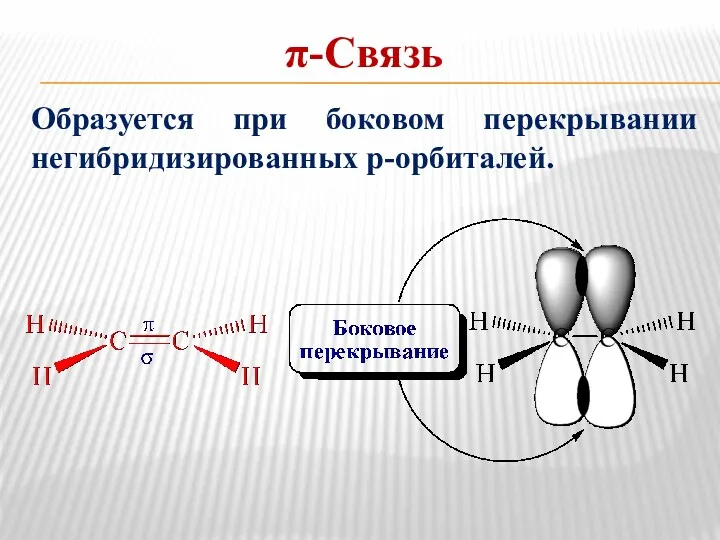
- 22. π-Связь Образуется при боковом перекрывании негибридизированных р-орбиталей.
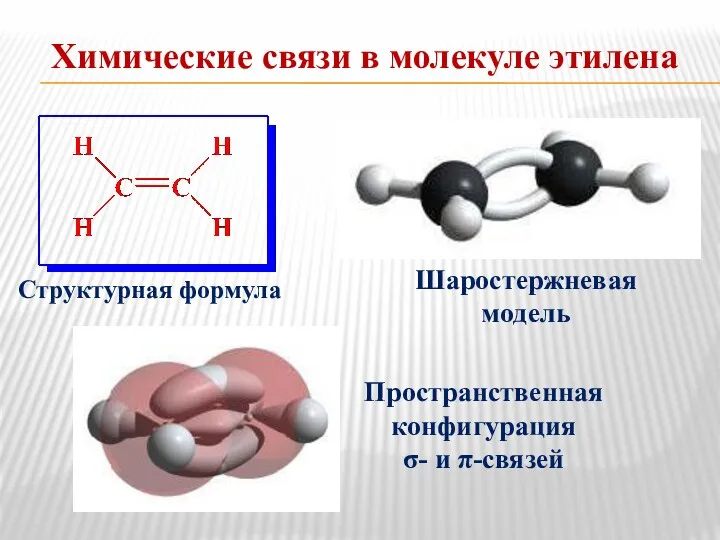
- 23. Химические связи в молекуле этилена Структурная формула Шаростержневая модель Пространственная конфигурация σ- и π-связей
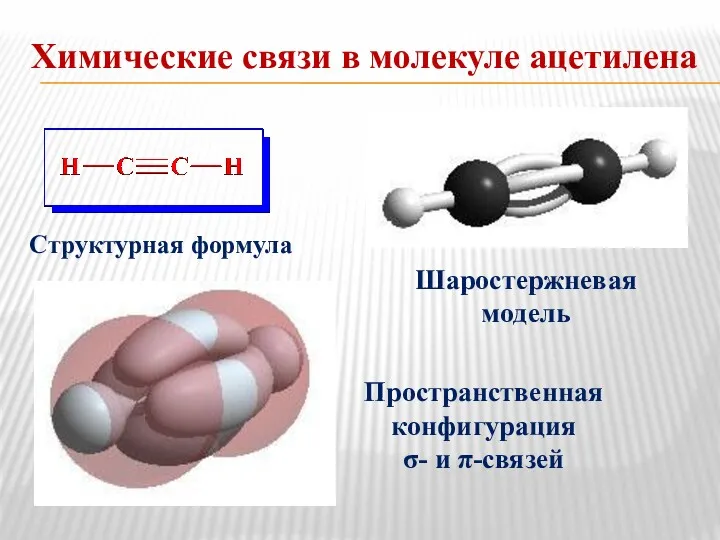
- 24. Химические связи в молекуле ацетилена Структурная формула Шаростержневая модель Пространственная конфигурация σ- и π-связей
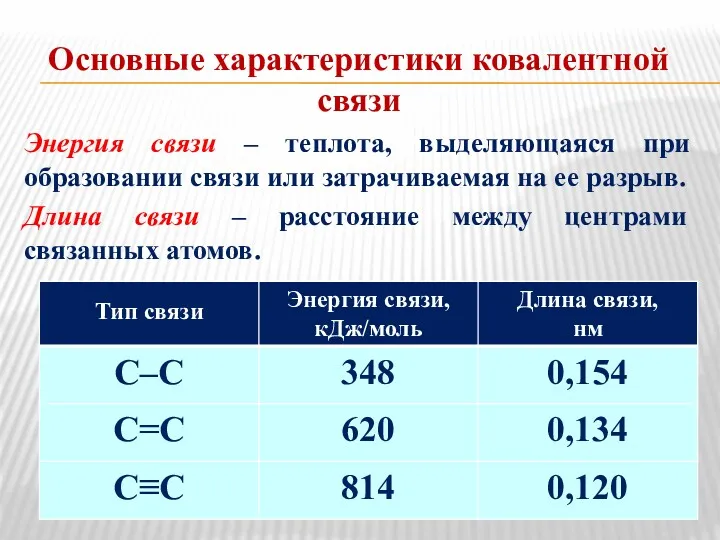
- 25. Основные характеристики ковалентной связи Энергия связи – теплота, выделяющаяся при образовании связи или затрачиваемая на ее
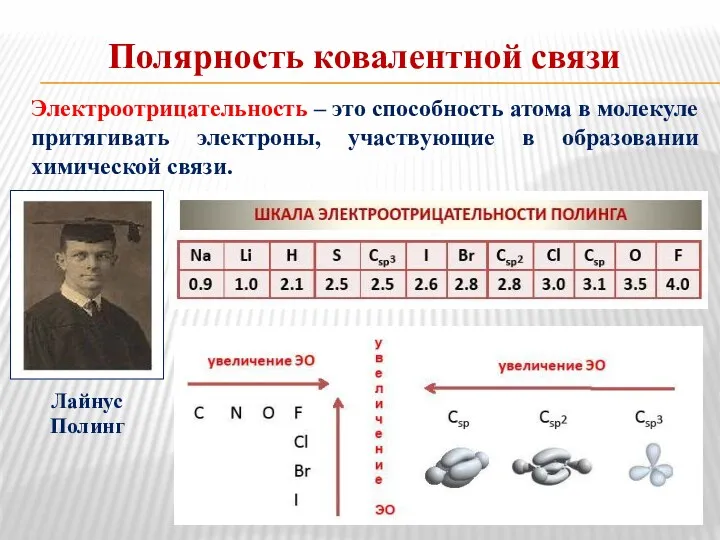
- 26. Полярность ковалентной связи Электроотрицательность – это способность атома в молекуле притягивать электроны, участвующие в образовании химической
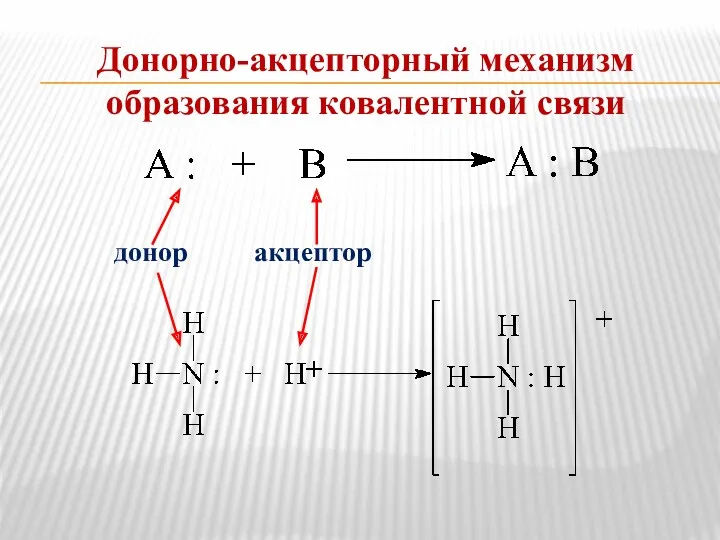
- 27. Донорно-акцепторный механизм образования ковалентной связи донор акцептор
- 28. Водородная связь Энергия водородной связи — 12,5 - 20 кДж/моль Характерна для органических соединений, имеющих атомы
- 29. Сопряжение Локализованная связь – это ковалентная связь, электронная пара которой находится в поле двух ядер и
- 30. Условия, необходимые для образования сопряженных систем Все атомы, участвующие в образовании сопряженной системы, находятся в sр2-гибридизации;
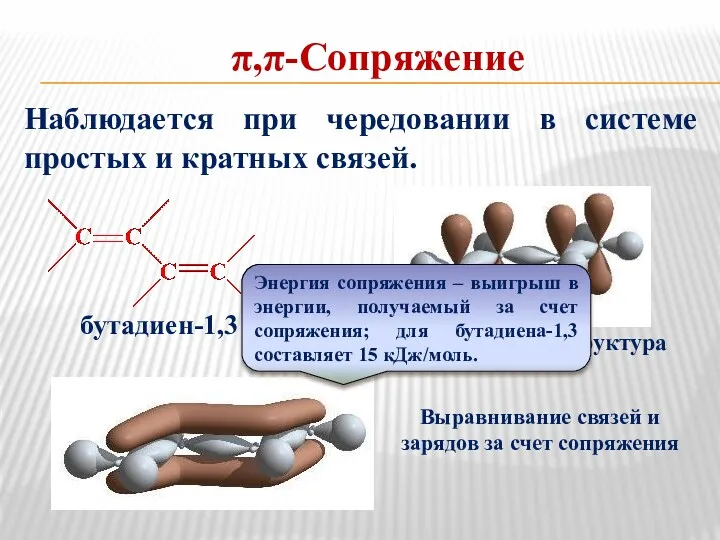
- 31. π,π-Сопряжение Наблюдается при чередовании в системе простых и кратных связей. Выравнивание связей и зарядов за счет
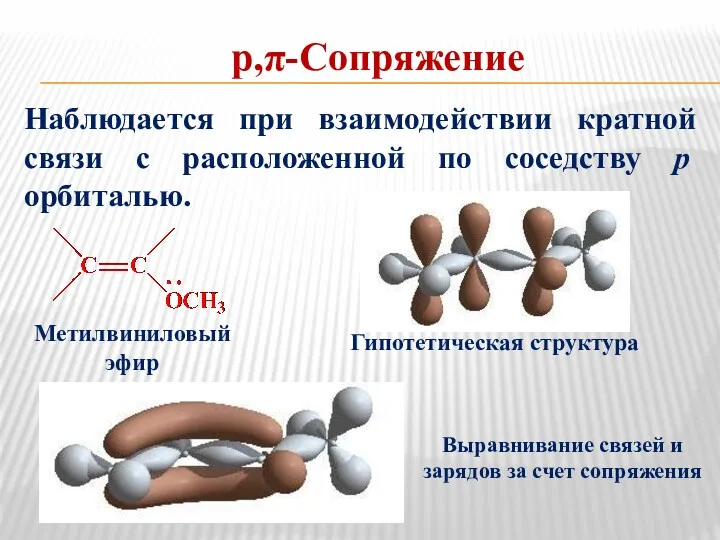
- 32. р,π-Сопряжение Наблюдается при взаимодействии кратной связи с расположенной по соседству рорбиталью. Метилвиниловый эфир Гипотетическая структура Выравнивание
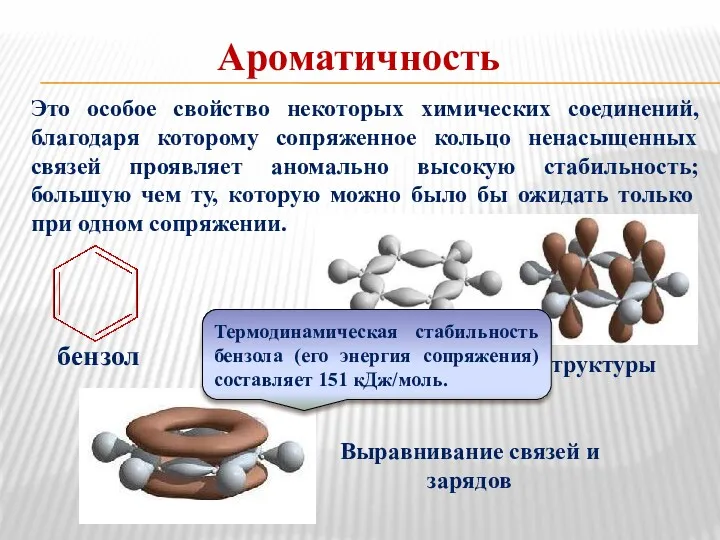
- 33. Ароматичность Это особое свойство некоторых химических соединений, благодаря которому сопряженное кольцо ненасыщенных связей проявляет аномально высокую
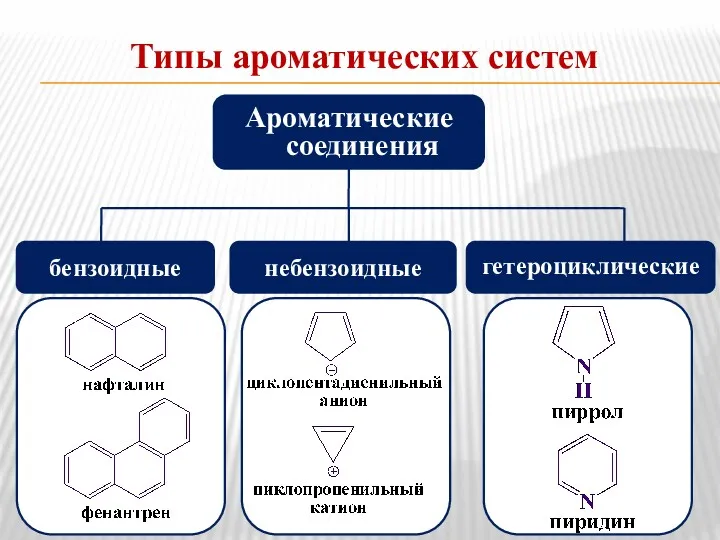
- 34. Типы ароматических систем Ароматические соединения бензоидные небензоидные гетероциклические
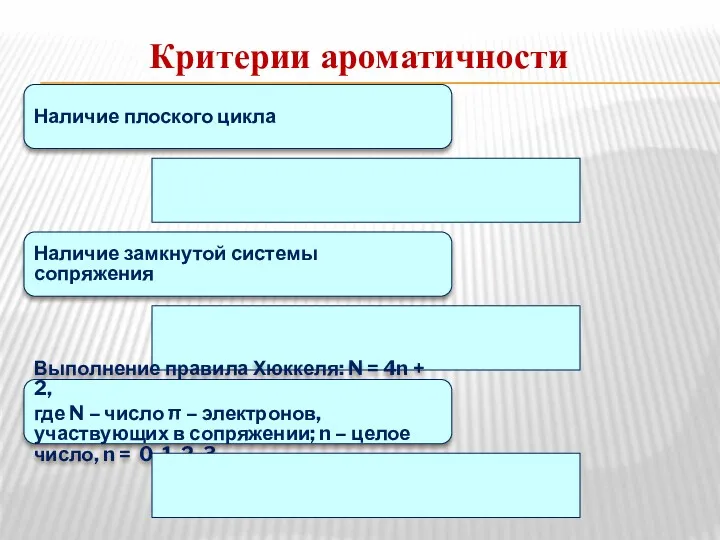
- 35. Критерии ароматичности Наличие плоского цикла Наличие замкнутой системы сопряжения Выполнение правила Хюккеля: N = 4n +
- 36. Взаимное влияние атомов в молекуле Взаимное влияние атомов в молекулах передается с помощью электронных и пространственных
- 37. Индуктивный эффект Индуктивный эффект (I) − передача электронного влияния заместителя в результате смещения электронов σ-связей. присутствует
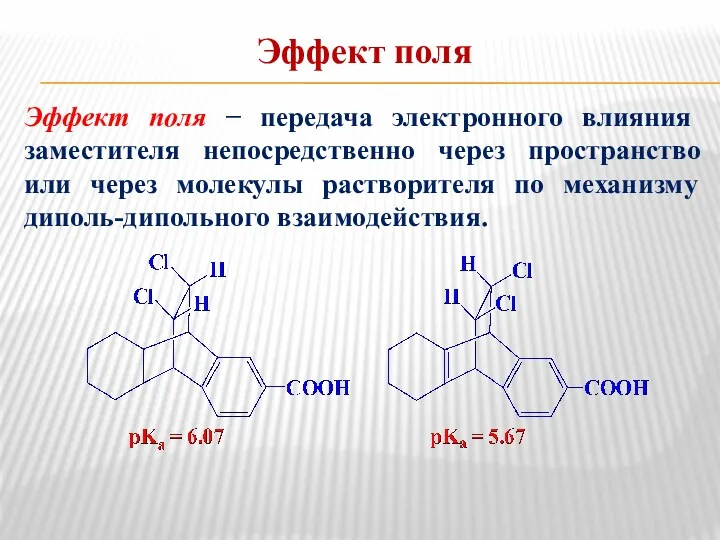
- 38. Эффект поля Эффект поля − передача электронного влияния заместителя непосредственно через пространство или через молекулы растворителя
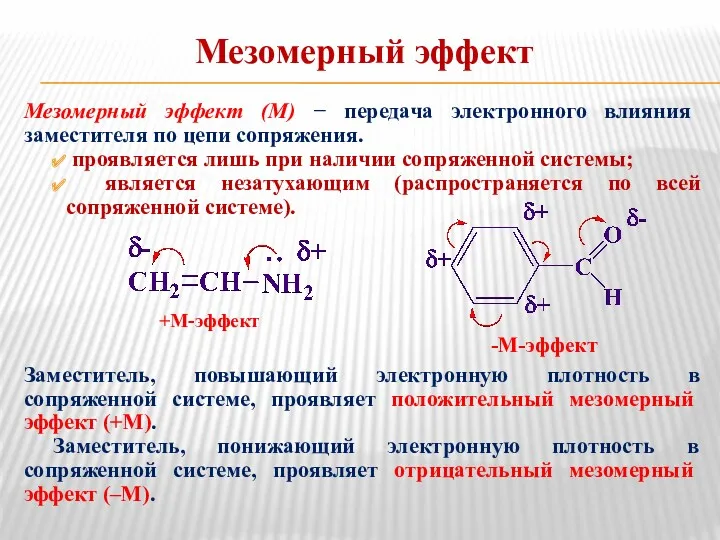
- 39. Мезомерный эффект Мезомерный эффект (М) − передача электронного влияния заместителя по цепи сопряжения. проявляется лишь при
- 41. Скачать презентацию














 Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Химическая связь в кластерах
Химическая связь в кластерах Количественный учет влияния заместителя на реакционную способность и его использование для интерпретации механизмов реакций
Количественный учет влияния заместителя на реакционную способность и его использование для интерпретации механизмов реакций Соли. Определение солей
Соли. Определение солей Электроизоляционные жидкости на основе синтетических углеводородов и других соединений
Электроизоляционные жидкости на основе синтетических углеводородов и других соединений 5-я группа элементов
5-я группа элементов Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Азот и его соединения. Повторение
Азот и его соединения. Повторение Строение атома (лекция 3)
Строение атома (лекция 3) Основные законы химии
Основные законы химии Полівінілхлорид
Полівінілхлорид Кремний в природе. Использование кремнезема для производства стекла. 9 класс
Кремний в природе. Использование кремнезема для производства стекла. 9 класс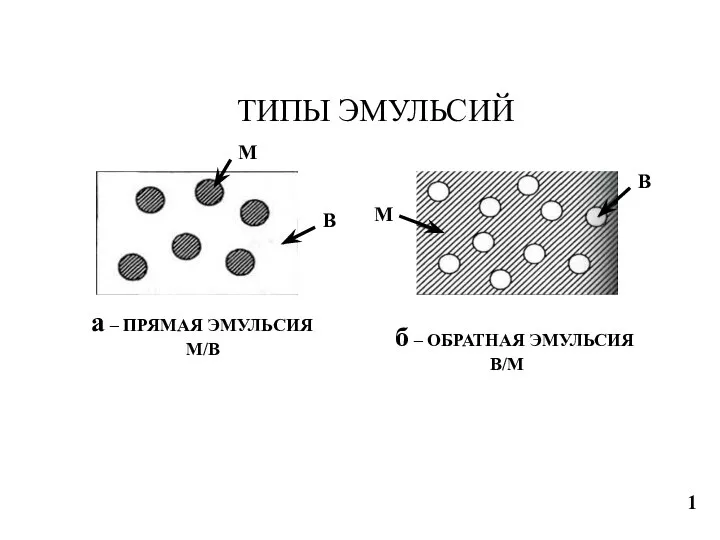 Типы эмульсий. Фракционный состав нефти. Типы нефти
Типы эмульсий. Фракционный состав нефти. Типы нефти Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева Электрохимические системы
Электрохимические системы Алюминий. Природные соединения алюминия
Алюминий. Природные соединения алюминия Химия атмосферы
Химия атмосферы Нанотехнологии и Наноматериалы
Нанотехнологии и Наноматериалы Медико-биологическое значение неметаллов. Йод
Медико-биологическое значение неметаллов. Йод Rates of reaction
Rates of reaction Расчет необходимого объема удобрения для внесения
Расчет необходимого объема удобрения для внесения Алканы
Алканы Кислородсодержащие органические соединения. Спирты. 10 класс
Кислородсодержащие органические соединения. Спирты. 10 класс Предмет органической химии. 9 класс
Предмет органической химии. 9 класс Нефть и способы её переработки
Нефть и способы её переработки Фенол и его свойства
Фенол и его свойства Алкены
Алкены Элементы теории горения
Элементы теории горения