Содержание
- 2. Цели и задачи Цель работы: получить хромат калия, изучить его физико-химические свойства. Задачи: 1. Сделать литературный
- 3. Физические свойства хромата калия Вещество K2CrO4 желтого цвета
- 4. К коллекционным минералам класса хроматов относятся хромат свинца и хромат калия. Название первого – крокоит, второго
- 5. Химические свойства хромата калия В разбавленных кислотах хромат переходит в дихромат: 2K₂CrO₄ + 2HCl → K₂Cr₂O₇
- 6. Способы получения хромата калия Прежде всего хромат калия может быть получен окислением оксида хрома (III) хлоратом
- 7. Применение хромата калия В качестве средства для мытья лабораторной посуды, так называемая «хромовая смесь». Хроматы калия
- 8. Нерастворимые хроматы некоторых металлов обладают яркими, насыщенными цветами, поэтому на их основе делают краски: жёлтые кроны
- 9. Термодинамический расчет Расчет энергии Гиббса для реакции в ионном виде: Cr2O72– + CO32– → 2CrO42– +
- 10. Для проведения синтеза понадобилось: Оборудование: электронные весы, ложечка, фарфоровая чашка, химический стакан, мерный цилиндр на 200
- 11. Синтез хромата калия Этапы синтеза: Взвесили необходимое количество K₂Cr₂O₇ и K₂CO₃. Растворили в химическом стакане в
- 12. Выход продукта
- 13. Качественное определение полученного соединения В кислой среде желтые хроматы переходят в оранжевые дихроматы: 2K₂CrO₄ + H₂SO₄
- 14. При добавлении к раствору хромата катионов бария выпадает ярко-желтый осадок хромата бария: K₂CrO₄ + BaCl₂ →
- 15. Хромат калия образует с ионами серебра кирпично-красный осадок хромата серебра: 2AgNO₃ + K₂CrO₄ → Ag₂CrO₄↓ +
- 17. Скачать презентацию
 Аминокилоты. Свойства
Аминокилоты. Свойства Многоатомные и одноатомные спирты
Многоатомные и одноатомные спирты Ароматические кислоты фенолокислоты
Ароматические кислоты фенолокислоты Комплексті қосылыстар
Комплексті қосылыстар Лаборатория красивых волос
Лаборатория красивых волос Соединения кальция. Жесткость воды и способы её устранения
Соединения кальция. Жесткость воды и способы её устранения Карбонилсодержащие соединения. Строение и химические свойства карбоновых кислот. Липиды. Фосфолипиды
Карбонилсодержащие соединения. Строение и химические свойства карбоновых кислот. Липиды. Фосфолипиды Organic Compounds
Organic Compounds Углерод и его соединения. 11 класс
Углерод и его соединения. 11 класс Жиры и масла в косметическом производстве
Жиры и масла в косметическом производстве Геохимические поиски. Региональные работы
Геохимические поиски. Региональные работы Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Коллоидные ПАВ. Мицеллообрaзование в растворах коллоидных ПАВ. Солюбилизация
Коллоидные ПАВ. Мицеллообрaзование в растворах коллоидных ПАВ. Солюбилизация Водород. Общая характеристика, получение, свойства
Водород. Общая характеристика, получение, свойства Чистые вещества и смеси
Чистые вещества и смеси Биохимическая трансформация веществ (2)
Биохимическая трансформация веществ (2) Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури
Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури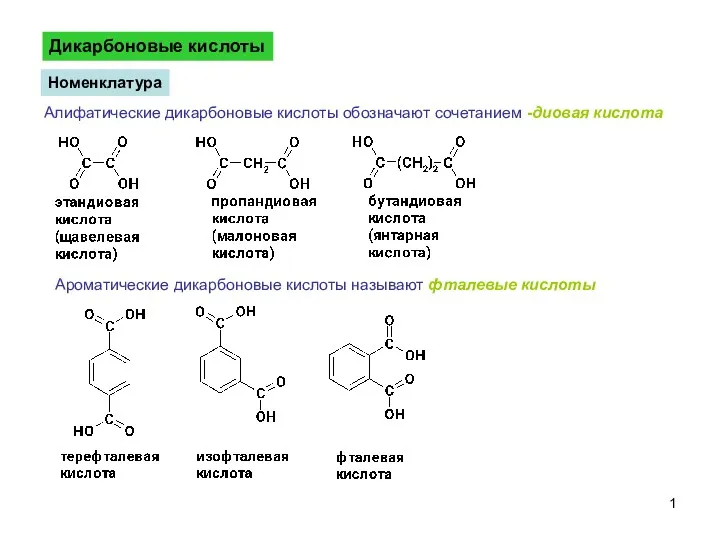 ДикарбоновыеКислоты-1
ДикарбоновыеКислоты-1 Летучие органические соединения (ЛОС)
Летучие органические соединения (ЛОС) ПЛАСТИК НОВЫЙ
ПЛАСТИК НОВЫЙ Углекислый газ
Углекислый газ Періодична система хімічних елементів
Періодична система хімічних елементів Решение задач по теме: «Электролиз»
Решение задач по теме: «Электролиз» Человек в мире веществ, материалов и химических реакций. Химия и пища
Человек в мире веществ, материалов и химических реакций. Химия и пища Непредельные углеводороды
Непредельные углеводороды Предельные углеводороды. Насыщенные алифатические углеводороды. Алканы или Парафины
Предельные углеводороды. Насыщенные алифатические углеводороды. Алканы или Парафины Кислородсодержащие соединения серы. Оксиды серы
Кислородсодержащие соединения серы. Оксиды серы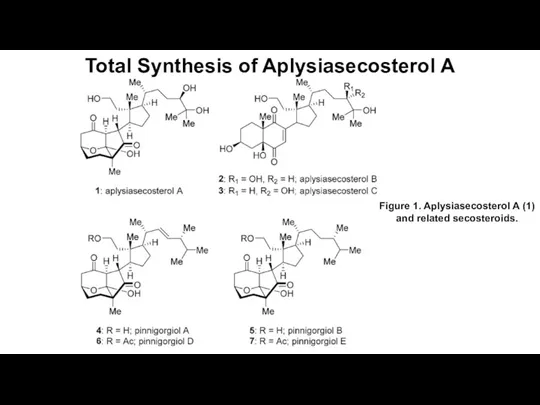 Total Synthesis of Aplysiasecosterol A
Total Synthesis of Aplysiasecosterol A