Содержание
- 2. Способы разделения веществ Фильтрование Декантация Действие магнита Хроматография Перегонка
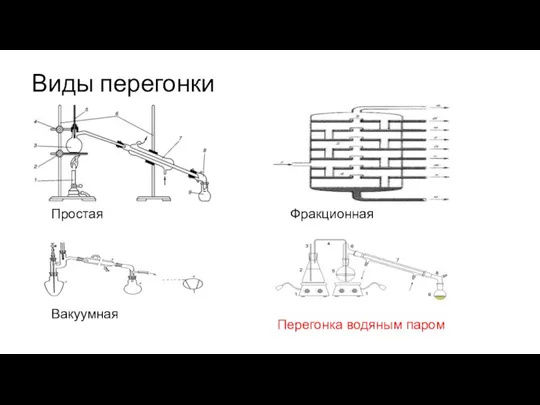
- 3. Виды перегонки Простая Фракционная Вакуумная Перегонка водяным паром
- 4. Закон Рауля РA=P0A*xA РB=P0B*xB Р= pA + pB В нашем случае закон не работает
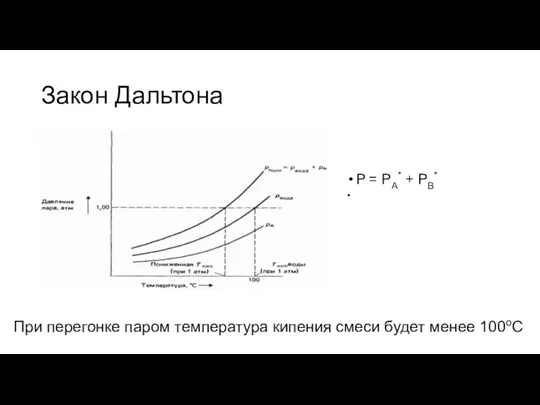
- 5. Закон Дальтона P = PA* + PB* При перегонке паром температура кипения смеси будет менее 100оС
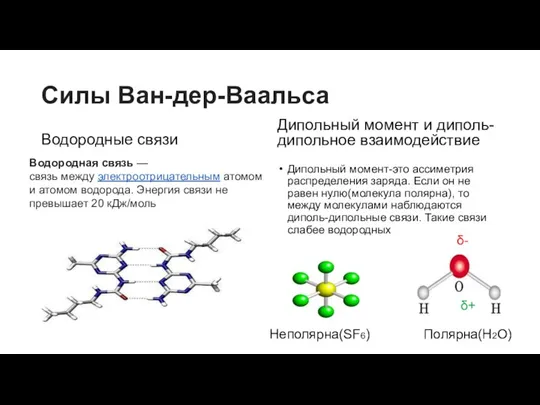
- 6. Силы Ван-дер-Ваальса Водородные связи Дипольный момент и диполь-дипольное взаимодействие Дипольный момент-это ассиметрия распределения заряда. Если он
- 7. Водородные связи Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно
- 8. Дипольный момент Дипольный момент электрический, векторная величина, характеризующая асимметрию распределения зарядов. Два одинаковых по величине заряда
- 9. Этим методом можно определить молярную массу Moлярную массу жидкости, не смешивающейся с водой, можно вычислить на
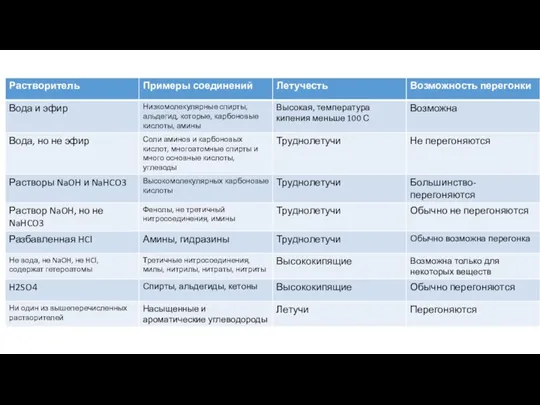
- 10. В этой таблице приведены некоторые свойства классов органических соединений, а также возможность перегонки водяным паром. Не
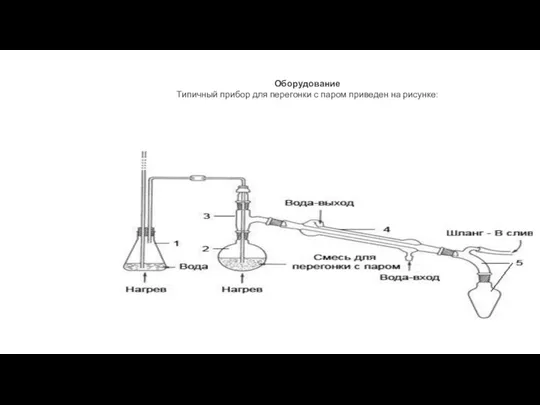
- 11. Оборудование Типичный прибор для перегонки с паром приведен на рисунке:
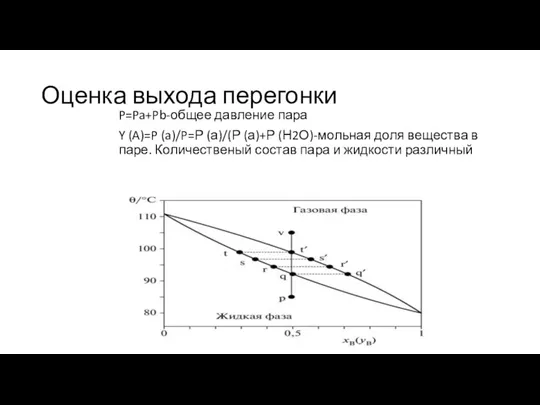
- 13. Оценка выхода перегонки P=Pa+Pb-общее давление пара Y (A)=P (a)/P=Р (а)/(Р (а)+Р (Н2О)-мольная доля вещества в паре.
- 14. Не перегоняются водяным паром Вещества с низким давлением пара при 100С (низкий выход) Вещества, разлагающиеся водой
- 15. Перегонка вещества с низким давлением пара Диэтаноламин: Tкипения-269 С-с разложением P100=0.45 мм рт. ст. Выход-меньше 0.5%
- 16. Перегонка вещества, реагирующего с водой Бензоилхлорид: T кип=197 С Реагирует с кипящей водой и водяным паром
- 17. Перегонки вещества, разлагающегося при температуре перегонки
- 18. Жидкости, которые можно использовать в перегонке помимо воды Вода-достаточно универсальное вещество, но ее не всегда используют
- 19. Перегонка в токе инертного газа. 1.Если вещество взаимодействует с водой, то вместо пара используется тот газ,
- 20. Закон распределения Закон распределения основан на экспериментальных наблюдениях. Рассмотрим, например, распределение иода между двумя несмешивающимися растворителями
- 21. Столь большое различие объясняется тем, что иод является неполярным растворяемым веществом. Поэтому он гораздо лучше растворим
- 22. Экстракция растворителем Две несмешивающиеся жидкости иногда используются как селективные растворители для компонентов какой-либо смеси. Такую смесь
- 23. Вывод В данной презентации я затронул тему очистки веществ, в частности перегонку паром. Данный метод используется
- 25. Скачать презентацию
















 Жидкостная хроматография
Жидкостная хроматография Рассмотрение продуктов цинкового производства при помощи аналитических методов анализа
Рассмотрение продуктов цинкового производства при помощи аналитических методов анализа Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7
Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7 Химическая связь и строение химических соединений
Химическая связь и строение химических соединений Органічні сполуки: ліпіди
Органічні сполуки: ліпіди Алкадиены
Алкадиены Типы химических реакций
Типы химических реакций Азотовмісні сполуки
Азотовмісні сполуки Coordination compounds
Coordination compounds Механохимиялық активтеу әдісі. Реакция түрлері
Механохимиялық активтеу әдісі. Реакция түрлері 20230330_zakony_termodinamiki_i_kinetika
20230330_zakony_termodinamiki_i_kinetika Нефть. Химический состав нефти
Нефть. Химический состав нефти Трансформация энергии в процессе оксигенного фотосинтеза
Трансформация энергии в процессе оксигенного фотосинтеза Флокуляційне очищення питної води за допомогою катіонних та аніонних флокулянтів
Флокуляційне очищення питної води за допомогою катіонних та аніонних флокулянтів Хімія у побуті
Хімія у побуті Темір және оның маңызды қосылыстары
Темір және оның маңызды қосылыстары Химические реакции
Химические реакции Петрология. Классификации магматических горных пород
Петрология. Классификации магматических горных пород Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение
Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение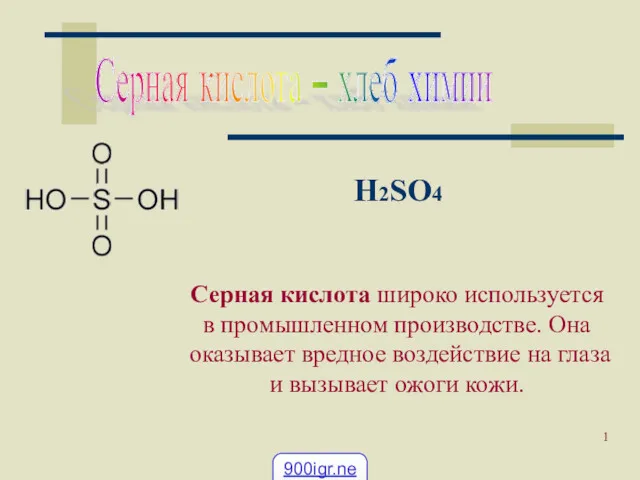 Применение серной кислоты
Применение серной кислоты Закономерности управления каталитическими процессами
Закономерности управления каталитическими процессами Основные классы неорганических соединений
Основные классы неорганических соединений Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Периодические изменения свойств химических элементов
Периодические изменения свойств химических элементов Спирты. Виды спирта
Спирты. Виды спирта Генетическая связь между классами органических соединений
Генетическая связь между классами органических соединений Ауыр түсті металдар
Ауыр түсті металдар Типы химических реакций. Тепловой эффект (11 класс)
Типы химических реакций. Тепловой эффект (11 класс)