Содержание
- 2. Большинство химических реакций протекают в растворах. Растворы электролитов содержат ионы, поэтому такие реакции сводятся к реакциям
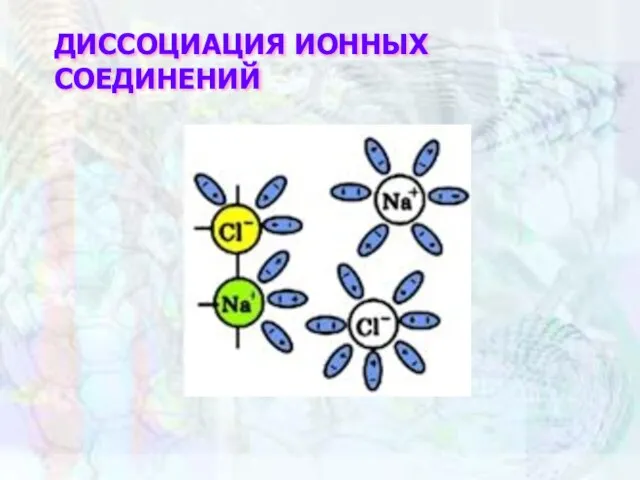
- 3. ДИССОЦИАЦИЯ ИОННЫХ СОЕДИНЕНИЙ
- 4. ДИССОЦИАЦИЯ СОЕДИНЕНИЙ С КОВАЛЕНТНОЙ ПОЛЯРНОЙ СВЯЗЬЮ
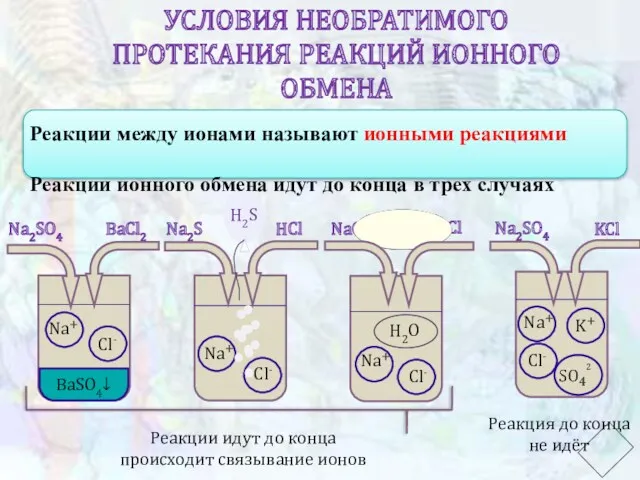
- 5. УСЛОВИЯ НЕОБРАТИМОГО ПРОТЕКАНИЯ РЕАКЦИЙ ИОННОГО ОБМЕНА Na2SO4 KCl Na2SO4 BaCl2 Реакция до конца не идёт Na2S
- 6. Если образуется осадок: CuSO4 + 2NaOH Na2SO4 + Cu(OH)2 2AgNO3 + CaCl2 Ca(NO3)2 + 2AgCl Na2CO3
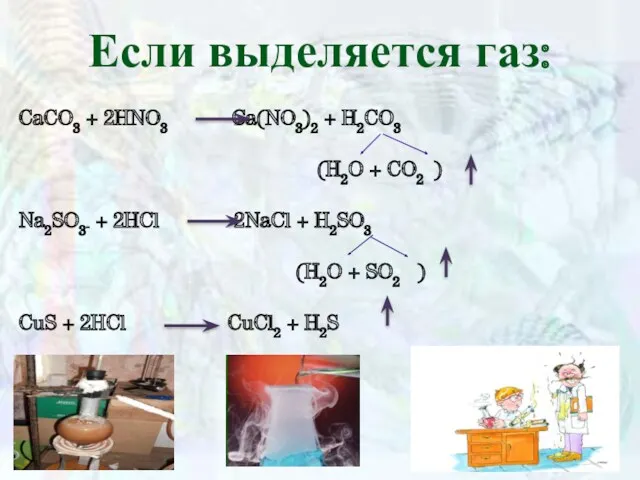
- 7. Если выделяется газ: CaCO3 + 2HNO3 Ca(NO3)2 + H2CO3 (H2O + CO2 ) Na2SO3 + 2HCl
- 8. Если образуется вода: CuO + H2SO4 CuSO4 + H2O Fe(OH)3 + 3HCl FeCl3 + 3H2O NaOH
- 9. Если НЕ образуются осадок, газ, вода, то реакции обмена обратимы: Обратимые реакции – это реакции, которые
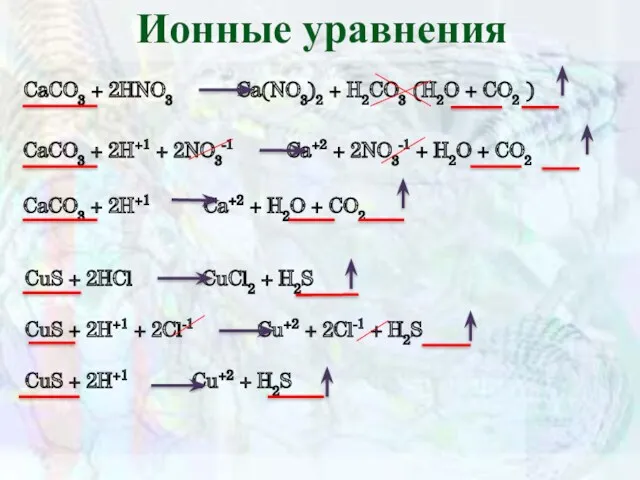
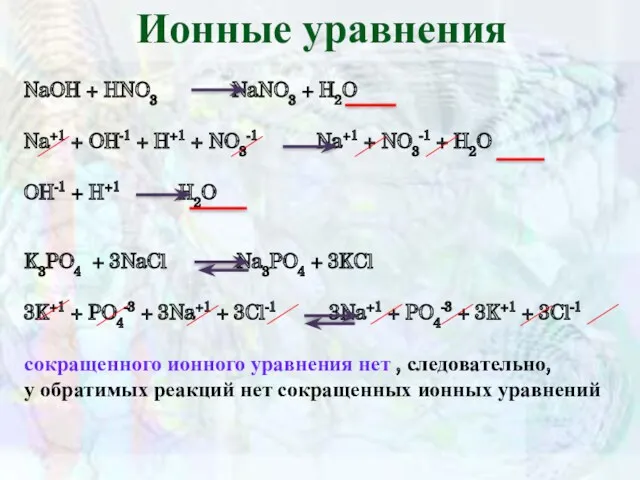
- 10. Ионные уравнения Для реакций ионного обмена составляют полные и сокращенные ионные уравнения. При этом на ионы
- 11. Ионные уравнения CaCO3 + 2HNO3 Ca(NO3)2 + H2CO3 (H2O + CO2 ) CaCO3 + 2H+1 +
- 12. Ионные уравнения NaOH + HNO3 NaNO3 + H2O Na+1 + OH-1 + H+1 + NO3-1 Na+1
- 13. ОБНАРУЖЕНИЕ ИОНОВ Ионы отличаются от нейтральных атомов строением и свойствами. Некоторые ионы бесцветны (например, ионы натрия
- 14. Реакцию, с помощью которой определяют наличие того или иного иона, называют качественной реакцией на этот ион.
- 16. Михаил и Алексей делали домашнее задание. Они составили уравнения реакций, но случайно на лист бумаги пролили
- 17. Внимание! Правильный ответ NaOH + HCl NaCl + H2O Na+1 + OH-1 + H+1 + Cl-1
- 18. Внимание! Правильный ответ (продолжение) 4) ZnSO4 + 2NaOH Zn(OH)2 + Na2SO4 Zn+2 + SO4-2 + 2Na+1
- 20. Скачать презентацию












 Основные классы неорганических соединений
Основные классы неорганических соединений Синтетический каучук и его применение
Синтетический каучук и его применение Теория растворов (лекция 2)
Теория растворов (лекция 2) Углеводы. 10 класс
Углеводы. 10 класс Составление уравнений ОВР
Составление уравнений ОВР Гидролиз солей. Гидроксиды
Гидролиз солей. Гидроксиды Алкени (етиленові вуглеводні, олефіни)
Алкени (етиленові вуглеводні, олефіни) Скорость химических реакций. Лекция 5
Скорость химических реакций. Лекция 5 Растворы. Способы выражения концентрации раствора
Растворы. Способы выражения концентрации раствора Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Классификация химических элементов. Амфотерность
Классификация химических элементов. Амфотерность Электролитическая диссоциация
Электролитическая диссоциация 5.Алкины
5.Алкины Химический элемент - водород
Химический элемент - водород Геохимия гидротермального процесса
Геохимия гидротермального процесса Щелочноземельные металлы
Щелочноземельные металлы Газовые законы для идеальных и реальных газов. Лекция 1
Газовые законы для идеальных и реальных газов. Лекция 1 Лихеоиндикация. Экологические аспекты переработки полимеров
Лихеоиндикация. Экологические аспекты переработки полимеров Начало нанотехнологической эры. Фуллерены
Начало нанотехнологической эры. Фуллерены Химический потенциал. Фазовые равновесия
Химический потенциал. Фазовые равновесия Коррозионная стойкость и повышение долговечности полимерных строительных материалов
Коррозионная стойкость и повышение долговечности полимерных строительных материалов Карбоновые кислоты. 10 класс
Карбоновые кислоты. 10 класс Аммиак (9 класс)
Аммиак (9 класс) Растворы электролитов и неэлектролитов. (Лекция 2)
Растворы электролитов и неэлектролитов. (Лекция 2) Ферменттер. Зерттелу тарихы
Ферменттер. Зерттелу тарихы Алканы
Алканы Строение и свойства железоуглеродистых сплавов. (4)
Строение и свойства железоуглеродистых сплавов. (4) Алканы
Алканы