Содержание
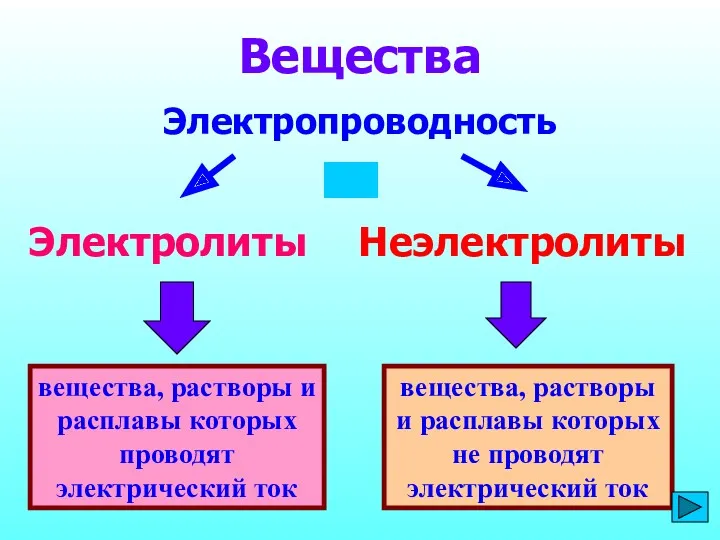
- 2. вещества, растворы и расплавы которых проводят электрический ток Вещества Электропроводность Электролиты Неэлектролиты вещества, растворы и расплавы
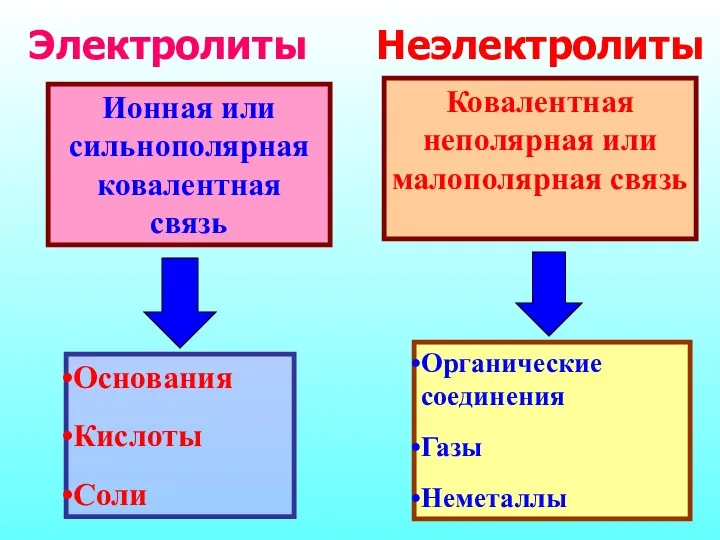
- 4. Ионная или сильнополярная ковалентная связь Основания Кислоты Соли Ковалентная неполярная или малополярная связь Органические соединения Газы
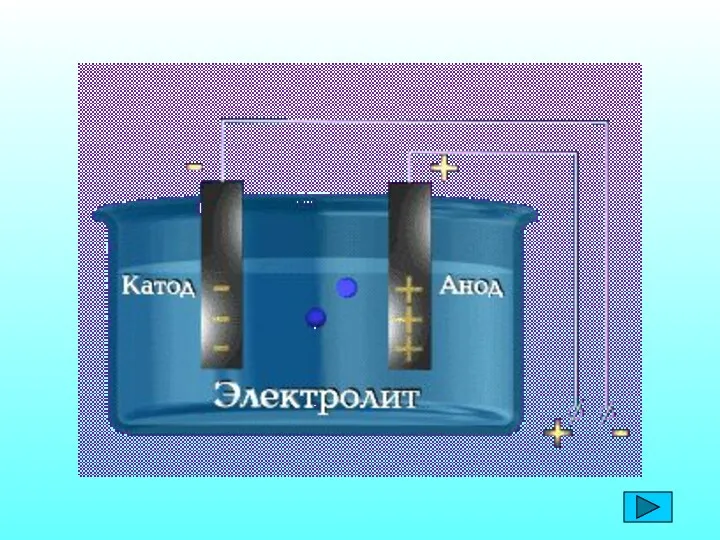
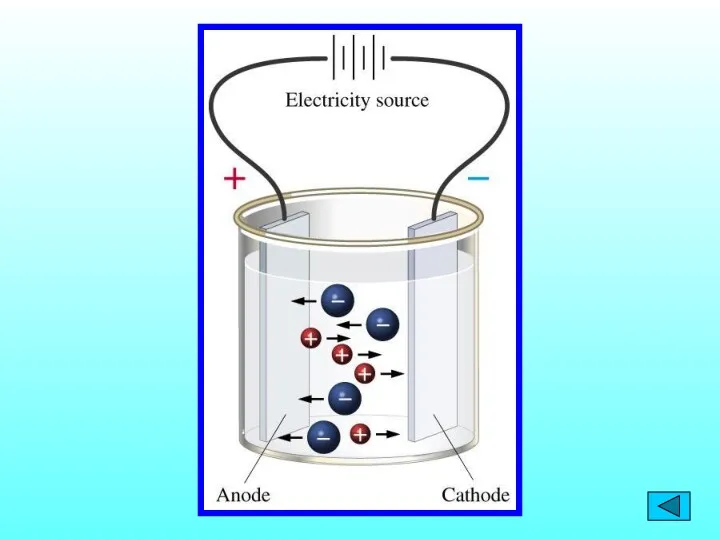
- 5. Теория электролитической диссоциации С. А. Аррениус (1859-1927) процесс растворения электролитов сопровождается образованием заряженных частиц, способных проводить
- 6. 1. Электролиты при растворении в воде распадаются на положительные и отрицательно заряженные ионы – электролитическая диссоциация.
- 9. Причины распада вещества на ионы в расплавах Нагревание усиливает колебания ионов в узлах кристаллической решётки -кристаллическая
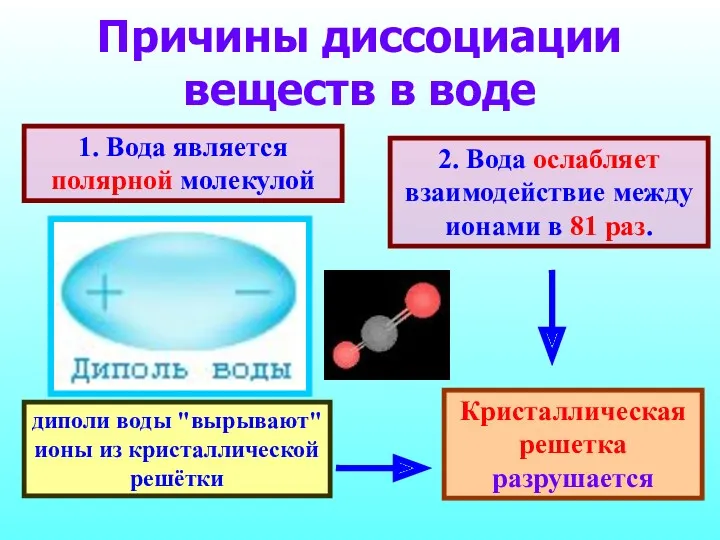
- 10. Причины диссоциации веществ в воде 1. Вода является полярной молекулой 2. Вода ослабляет взаимодействие между ионами
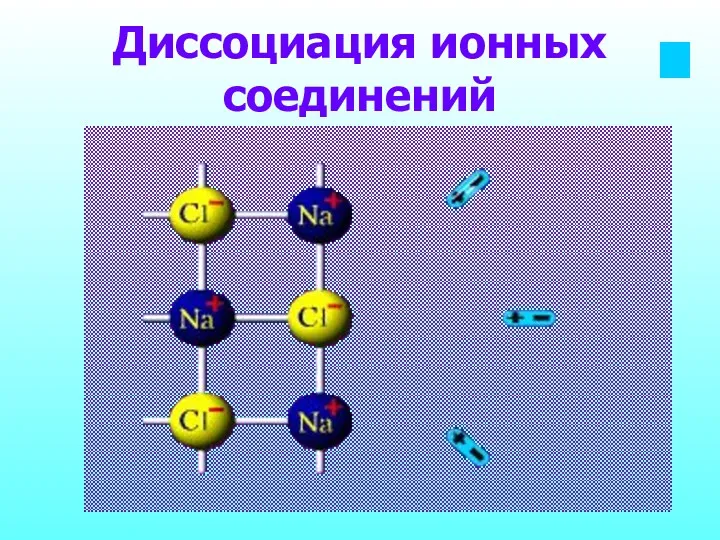
- 11. Диссоциация ионных соединений
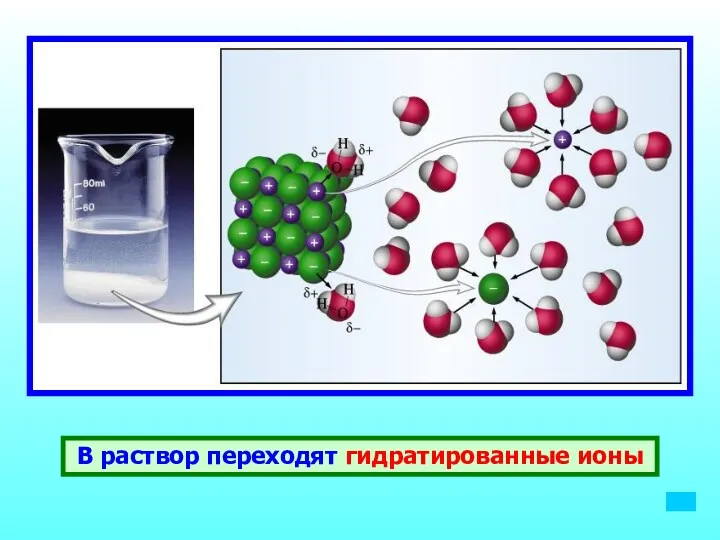
- 12. В раствор переходят гидратированные ионы
- 13. Диссоциация соединений с КП связью
- 14. Образование в результате распада электролитов гидратированных ионов отражается при написании уравнений диссоциации, однако, чаще эти уравнения
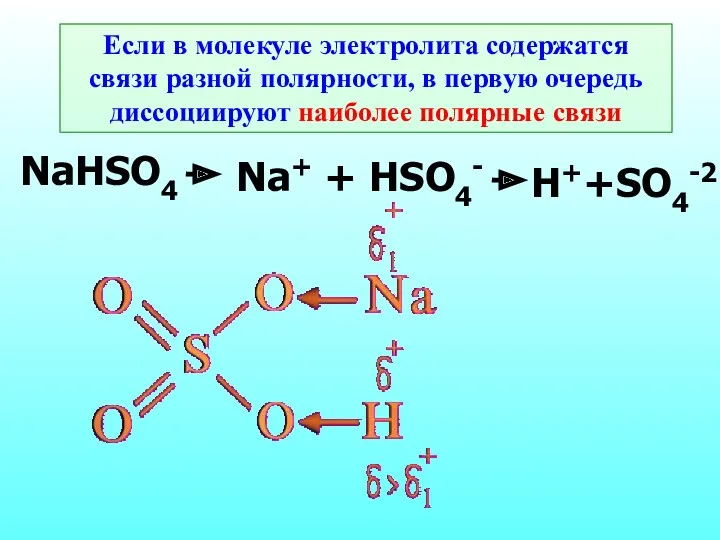
- 15. Если в молекуле электролита содержатся связи разной полярности, в первую очередь диссоциируют наиболее полярные связи NaHSO4
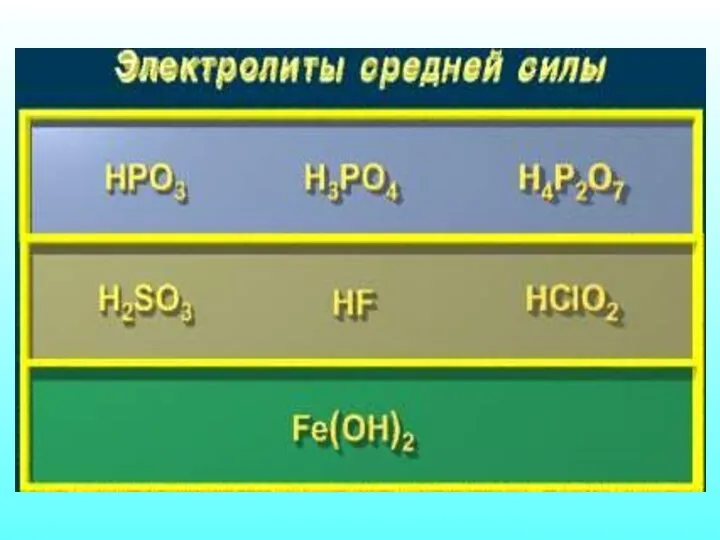
- 16. Количественная характеристика процесса диссоциации Отношение числа распавшихся молекул к общему числу молекул в растворе Сила электролита
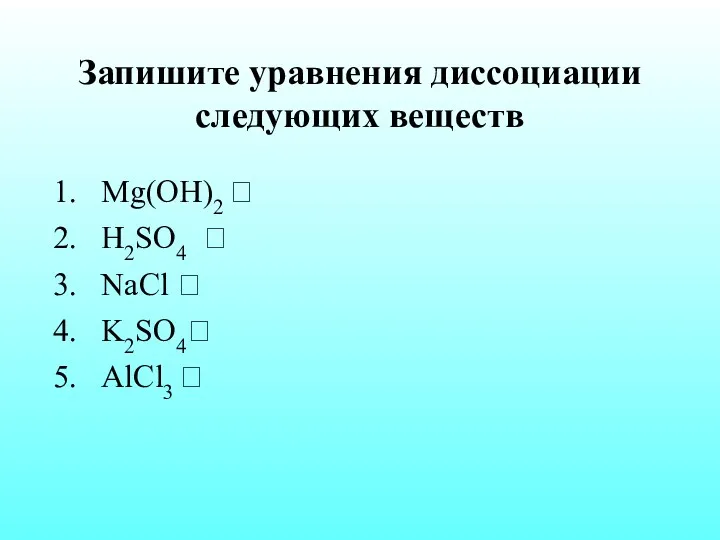
- 18. Запишите уравнения диссоциации следующих веществ Mg(OH)2 ? H2SO4 ? NaCl ? K2SO4? AlCl3 ?
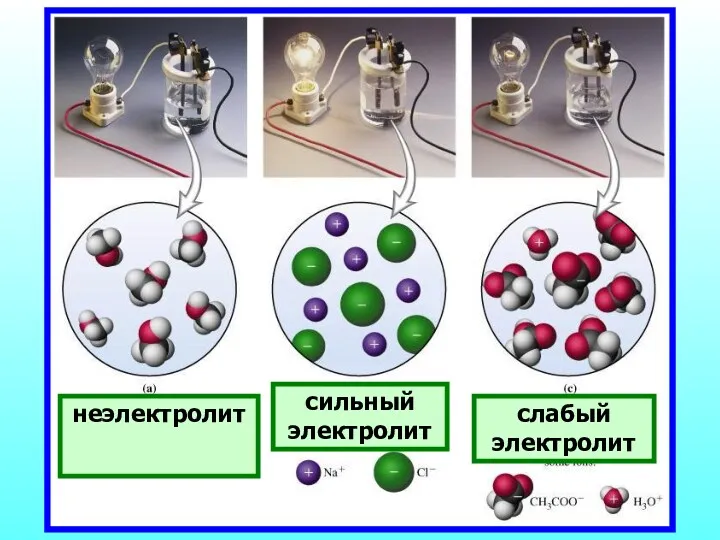
- 19. неэлектролит сильный электролит слабый электролит
- 23. Скачать презентацию









 Макро, микро и ультрамикроэлементы. Их роль
Макро, микро и ультрамикроэлементы. Их роль Знаки вторичной переработки
Знаки вторичной переработки Физико-химические свойства алкенов
Физико-химические свойства алкенов Оксигеновмісні сполуки. Одноатомні та багатоатомні спирти. Феноли. Лекція №6
Оксигеновмісні сполуки. Одноатомні та багатоатомні спирти. Феноли. Лекція №6 Химия в повседневной жизни человека
Химия в повседневной жизни человека Фенол. 10 класс
Фенол. 10 класс Каучук. Немного из истории
Каучук. Немного из истории Химические превращения веществ
Химические превращения веществ Основания - свойства ТЭД
Основания - свойства ТЭД Химические свойства оксидов
Химические свойства оксидов Алюминий и его сплавы
Алюминий и его сплавы Химическая промышленность и химические технологии
Химическая промышленность и химические технологии Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Фторопласт-4 (тефлон, політетрафлуоретен)
Фторопласт-4 (тефлон, політетрафлуоретен) Жиры. Мыла. СМС. 10 класс
Жиры. Мыла. СМС. 10 класс La notion de catabolisme et d’anabolisme. La bioenergetique. La chaine mitochondriale de transfert d’electrons
La notion de catabolisme et d’anabolisme. La bioenergetique. La chaine mitochondriale de transfert d’electrons Hydrophilization and hydrophobization of the surface of solids with the help of SAA
Hydrophilization and hydrophobization of the surface of solids with the help of SAA Plastics слайды
Plastics слайды Оценка химической обстановки при авариях на химически опасных объектах
Оценка химической обстановки при авариях на химически опасных объектах Электролиз
Электролиз Окисно-відновні реакції та їхнє значення
Окисно-відновні реакції та їхнє значення Пищевые добавки
Пищевые добавки Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие Закономерности протекания химических реакций
Закономерности протекания химических реакций Органические производные пятивалентного фосфора. Способы получения
Органические производные пятивалентного фосфора. Способы получения Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования Гидролиз солей
Гидролиз солей Галогены (солеобразующие)
Галогены (солеобразующие)