Слайд 2
Слайд 3

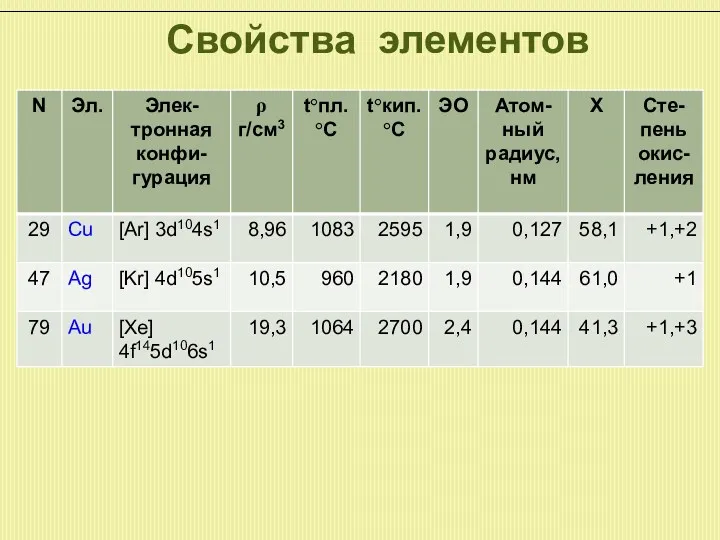
Медь, серебро и золото относятся к d-элементам. Электронная формула ...(n-1)s2p6d10ns1. Хотя
предпоследний уровень полностью заполнен, он не достаточно стабилен и поэтому элементы могут проявлять различные валентности и степени окисления.
По сравнению с щелочными металлами притяжение наружных электронов к ядру сильнее, т.к. радиус атомов меньше и химическая активность (идет заполнение предыдущего уровня) значительно ниже.
В ряду напряжения все эти элементы стоят после водорода, т.е. не вытесняют его из кислот. Серебро и золото на воздухе не окисляются, гидридов все три элемента не образуют. Являются хорошими комплексообразователями. Склонны к образованию интерметаллических соединений.
Слайд 4

Медь
В природе встречается в виде следующих соединений: Cu2S – медный блеск,
Cu2O - куприт, CuFeS2 - медный колчедан, Cu2(OH)2CO3 - малахит.
Получение
Для производства меди значение имеют сульфидные руды. Переработка основана на том, что сульфиды переводят в оксиды обжигом , затем оксид восстанавливают.
Cu2S+2О2=2CuO+SO2
- Пирометаллургия:
CuO + C = Cu + CO
CuO + CO = Cu + CO2
- Гидрометаллургия:
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + Fe = FeSO4 + Cu
Полученная "черновая" медь содержит в качестве примесей Fe, Zn, Pb, Bi, Sb.
Слайд 5

Для получения чистой электротехнической меди ее подвергают рафинированию, т.е. в электролизную
ванну в качестве анода помещают "черновую" медь, в качестве катода - чистую медь, Электролит - раствор сульфата меди. Процесс электролиза ведут таким образом, чтобы на катоде шло восстановление только меди, а примеси уходили в шлам. В чистом виде медь - металл красного цвета, вязкий, пластичный, с высокой тепло- и электропроводностью.
Электролиз:
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4
(на катоде) (на аноде)
Слайд 6

Халькози́н (греч. χαλχοζ — медь), ме́дный блеск
Слайд 7

Слайд 8

Слайд 9

Слайд 10

Химические свойства
Взаимодействует с неметаллами при высоких температурах.
Фтор, хлор, бром реагируют
с медью, образуя галогениды:
Cu+Сl2= CuСl2
При взаимодействии иода с нагретым порошком меди получается иодид одновалентной меди:
2Cu+I2= 2CuI
Медь горит в парах серы:
Cu+S = CuS
Медь стоит в ряду напряжений правее водорода, поэтому не реагирует с разбавленными соляной и серной кислотами, но растворяется в кислотах – окислителях:
3Cu + 8HNO3(р) = 3Cu(NO3)2 + 2NO + 2H2O
Cu + 4HNO3(к) = Cu(NO3)2 + 2NO2 + 2H2O
Cu + 2H2SO4(к) = CuSO4 + SO2 +2H2O
Сплавы меди с оловом - бронзы, с цинком - латуни.
Слайд 11

При прокаливании на газовой горелке медь покрывается черным налетом оксида меди
(II) CuO:
2Cu+O2=2CuO
Если быстро опустить в воду раскаленный докрасна кусок меди, то на его поверхности образуется ярко-красная пленка Cu2O:
4Cu+O2=2Cu2O
Оба оксида в воде не растворимы. Соответствующие основания:
CuOH - желтого цвета,
Cu(OH)2 - голубого цвета.
Слайд 12

Медь химически малоактивна и в чистом сухом воздухе не изменяется. Однако
атмосфера, в которой мы живем, содержит водяные пары и углекислый газ, поэтому со временем медь покрывается зеленоватым налетом основного карбоната меди (ядовитое):
2Cu+O2+СО2+Н2О=Cu(ОН)2•CuСО3
Слайд 13

Слайд 14

Соединения одновалентной меди
Встречаются либо в нерастворимых соединениях (Cu2O, Cu2S, CuCl), либо
в виде растворимых комплексов (координационное число меди – 2):
CuCl + 2NH3 = [Cu(NH3)2]Cl
Оксид меди (I) – также можно получать восстановлением соединений меди (II), например, глюкозой в щелочной среде:
2CuSO4 + C6H12O6 + 5NaOH =
Cu2O + 2Na2SO4 + C6H11O7Na + 3H2O
Гидроксид меди CuOH (желтого цвета) получают:
CuCl + NaOH = CuOH + NaCl
Слайд 15

Соединения двухвалентной меди
Оксид меди (II) восстанавливается под действием сильных восстановителей (например,
CO) до меди. Обладает основным характером, при нагревании растворяется в кислотах:
CuO + H2SO4 = CuSO4 + H2O
CuO + 2HNO3 = Cu(NO3)2 + H2O
Гидроксид меди (II) Cu(OH)2 - нерастворимое в воде вещество светло-голубого цвета. Образуется при действии щелочей на соли меди (II):
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
При нагревании чернеет, разлагаясь до оксида:
Cu(OH)2 = CuO + H2O
Слайд 16

Амфотерное основание. Растворяется в кислотах и щелочах:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Cu(OH)2 +
2NaOH = Na2[Cu(OH)4]
Растворяется в растворе аммиака с образованием комплексного соединения (координационное число меди – 4) василькового цвета (реактив Швейцера, растворяет целлюлозу):
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
Малахит Cu2(OH)2CO3 искусственно можно получить по реакции:
2CuSO4 + 2Na2CO3 + H2O =
Cu2(OH)2CO3 + 2Na2SO4 + CO2
Разложение малахита:
Cu2(OH)2CO3 = 2CuO + CO2 + H2O
Слайд 17

Соли меди в водных растворах, как правило, окрашены в зелено-голубой цвет,
многие из них образуют кристаллогидраты:
CuSO4.5H2O, CuCl2.4H2O, Cu(CH3COO)2.2H2O.
Используются как средство борьбы с вредителями и для протравки семян.
Медь имеет большое значение в технике при производстве сплавов, это латуни, бронзы и медно-никелевые.
Слайд 18

Приблизительный состав некоторых наиболее
известных сплавов на основе меди:
бронза (обычная) - 90%
Сu + 10% Sn
томпак - 90 % Cu + 10 % Zn
манганин - 86 % Сu + 12 % Мn + 2 % Ni;
мельхиор - 68 % Cu + 30 % Ni + 1 % Мn + 1 % Fе
нейзильбер - 65 % Сu +20 % Zn +15 % Ni
латунь (обычная) - 60 % Сu + 40 % Zn
константан - 59 % Сu +40 % Ni +1 % Мn.
Слайд 19

Для выделки украшений пригоден золотистый сплав, состоящий из 85 % Сu,
13 % Zn и 2 % Sn. Еще более похож на золото сплав состава 90 % Сu, 7,5 % Al и 2 % Au. Разменная монета СССР содержала 95 % Сu и 5 % Аl (до 5 коп.) или 80 % Сu и 20 % Ni (10 коп. и выше). Легко растирающийся в порошок сплав состава 50 % Cu, 45 % Al, 5 % Zn («сплав Деварда») иногда применяется в качестве восстановителя. Из воды сплав этот выделяет водород уже на холоду.
Слайд 20

СЕРЕБРО
В природе встречается в самородном состоянии, в виде минерала аргентита -
Ag2S, до 1% серебра содержится в свинцовых рудах.
Получают серебро из сульфидной руды гидрометаллургическим способом переводом его в цианид с последующим восстановлением цинком:
Ag2S +4KCN = 2K[Ag(CN)2] + K2S
2K[Ag(CN)2] + Zn = 2Ag + K2[Zn(CN)4]
Серебро - белый, блестящий металл с высокой пластичностью. Обладает самой высокой электропроводностью.
Слайд 21

Слайд 22

Название элемента происходит от древнегреческого слова argentos (происходящий от света).
В
честь серебра названа целая страна – Аргентина. Первое использование имени “Аргентина”, может быть найдено в отчетах первых путешествий испанских и португальских завоевателей в Рио-де-ла-Плата (что означает “Серебряная река”), в начале 16 века.
Слайд 23

Химические свойства
Благородный металл, устойчивый на воздухе. При потускнении серебра происходит реакция
Гепара:
4Ag + 2H2S + O2 = 2Ag2S + 2H2O
Ag2 S -наиболее труднорастворимая соль серебра
В ряду напряжений находится правее водорода, поэтому растворяется только в кислотах - окислителях:
3Ag + 4HNO3(р) = 3AgNO3 + NO + 2H2O
Ag + 2HNO3(к) = AgNO3 + NO2 + H2O
2Ag + 2H2SO4(к) = Ag2SO4 + SO2 + 2H2O
Слайд 24

В соединениях серебро обычно проявляет степень окисления +1. Растворимый нитрат серебра
AgNO3 используется как реактив для качественного определения галоген-ионов:
Ag+ + Cl- = AgCl ↓ белый
Ag+ + Br- = AgBr ↓ светло-жёлтый
Ag+ + I- = AgI ↓ тёмно-жёлтый
Способность этих осадков образовывать растворимые комплексные соединения уменьшаются в ряду AgCl – AgBr – AgI. На свету галогениды серебра постепенно разлагаются с выделением серебра.
При добавлении растворов щелочей к раствору AgNO3 образуется тёмно-коричневый осадок оксида серебра Ag2O:
2AgNO3 + 2NaOH = Ag2O + 2NaNO3 + H2O
Слайд 25

Осадки AgCl и Ag2O растворяются в растворах аммиака с образованием комплексных
соединений (координационное число серебра – 2):
AgCl + 2NH3 = [Ag(NH3)2]Cl
Ag2O + 4NH3 + H2O 2[Ag(NH3)2]OH
Коричневый осадок Ag2O плохо растворим в воде, однако при добавлении фенолфталеина раствор окрашивается в розовый цвет за счет образования гидроксида серебра:
Ag2O + H2O = 2AgOH
Равновесие этой реакции сильно сдвинуто влево.
Ag2O - хороший восстановитель и с глюкозой дает реакцию "серебряного зеркала":
Ag2O + C6H12O6 = 2Ag + C6H12O7 (глюконовая кислота)
Слайд 26

Из солей серебра в воде растворима только AgNO3.
Серебро хороший комплексообразователь, образует
аммиачные, циано- и тиосульфатные комплексы:
AgCl + 2NH3 = [Ag(NH3)2]Cl
AgBr + 2Na2S2O3 = Na3[Ag(S2O3)2] + NaBr
На последней реакции основано действия закрепителя в фотографии, когда незасвеченные участки на фотопленке, содержащие AgBr растворяются тиосульфатом натрия.
85% всего добываемого серебра идет на изготовление светочувствительных слоев для фото- и кинопромышленности. Серебро используется в электро- и радиотехнической промышленности, в ювелирном деле, медицине.
Слайд 27

ЗОЛОТО
В природе встречается в самородном состоянии и в виде минералов AuTe2
- калаверит, AgAuTe4 - сильванит.
Золото - мягче Cu и Ag, ковкий металл; легко образует тончайшую фольгу; благородный металл, устойчив как в сухом, так и во влажном воздухе.
Золото является основой денежной системы большинства стран. Помимо этого, золото применяется в электротехнической промышленности, употребляется для выделки различных предметов роскоши, золочения других металлов и т. и. Соединения золота используются главным образом в фотографии и в медицине.
Мировая добыча золота составляла в 1800 г. - 18 т, в 1900 г. - 400 т. В настоящее время ежегодно добывают около 1500 т. Золотой запас всех зарубежных стран оценивается в 50 тыс. т.
Слайд 28

Слайд 29

Слайд 30

Для извлечения Au размолотую золотосодержащую породу обрабатывают при доступе воздуха очень разбавленным (0,03–0,2%) раствором NaCN.
При этом золото по уравнению:
4Au + 8NaCN + 2H2O + О2 = 4Na[Au(CN)2] + 4NaOH
переходит в раствор, из которого затем выделяется действием металлического цинка:
2Na[Au(CN)2] + Zn = Na2[Zn(CN)4] + 2Au
Очистка полученного тем или иным путем золота от примесей («аффинаж») производится чаще всего обработкой его горячей концентрированной H2SO4 или при помощи электролиза.
Слайд 31

Золото — самый инертный металл, стоящий в ряду напряжений правее всех других металлов,
при нормальных условиях оно не взаимодействует с большинством кислот и не образует оксидов, благодаря чему было отнесено к благородным металлам. Затем была открыта способность царской водки растворять золото, что поколебало уверенность в его инертности:
Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O
Реагирует с галогенами при нагревании:
2Au + 3Cl2 = 2AuCl3
Соединения термически не очень устойчивы и разлагаются при нагревании с выделением металла. Комплексообразователь (комплексы золота (III) обладают координационными числами 4, 5 и 6).
Слайд 32

Наиболее устойчивая степень окисления золота в соединениях +3, в этой степени
окисления оно легко образует с однозарядными анионами (F−, Cl−. CN−) устойчивые плоские квадратные комплексы [AuX4]−. Относительно устойчивы также соединения со степенью окисления +1, дающие линейные комплексы [AuX2]−. Высшая из возможных степеней окисления золота Au+5 (фторид AuF5, соли комплекса [AuF6]−):
2Au + 5KrF2 → 2AuF5 + 5Kr↑
Соединения золота(V) стабильны лишь со фтором и являются сильнейшими окислителями.
Слайд 33

Степень окисления +2 для золота нехарактерна, в веществах, в которых она
формально равна 2, половина золота, как правило, окислена до +1, а половина — до +3, например, правильной ионной формулой сульфата золота(II) AuSO4 будет не Au2+(SO4)2−, а Au1+Au3+(SO4)2−2.
Из чистых кислот золото растворяется только в горячей концентрированной селеновой кислоте:
2Au + 6H2SeO4 = Au2(SeO4)3 + 3H2SeO3 + 3H2O
Золото сравнительно легко реагирует с кислородом и другими окислителями при участии комплексобразователей. Так, в водных растворах цианидов при доступе кислорода золото растворяется, образуя цианоаураты:
4Au + 8КCN + 2H2O + O2 → 4К[Au(CN)2] + 4КOH
































 Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Термические процессы нефтепереработки
Термические процессы нефтепереработки Факторы и процессы формирования химического состава подземных вод
Факторы и процессы формирования химического состава подземных вод Органическая химия. Вещества
Органическая химия. Вещества Одноосновные карбоновые кислоты. Строение, физические свойства, номенклатура
Одноосновные карбоновые кислоты. Строение, физические свойства, номенклатура Неоднородные смеси
Неоднородные смеси Интересные свойства редких металлов
Интересные свойства редких металлов Алкины. Ацетиленовые углеводороды
Алкины. Ацетиленовые углеводороды Задания С 3 для подготовки к ГИА -9 по химии
Задания С 3 для подготовки к ГИА -9 по химии Высокомолекулярные соединения. Общие понятия
Высокомолекулярные соединения. Общие понятия Образование ионов
Образование ионов Распределение электронов в атомах. 8 класс
Распределение электронов в атомах. 8 класс Конструкционные функциональные волокнистые композиты
Конструкционные функциональные волокнистые композиты Водородная связь
Водородная связь Азот қышқылы
Азот қышқылы Геохимия магматического процесса
Геохимия магматического процесса Технология лаков и красок
Технология лаков и красок Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью
Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью Галогены. Положение в периодической системе. Химические свойства
Галогены. Положение в периодической системе. Химические свойства Непредельные углеводороды. Этилен и его гомологи
Непредельные углеводороды. Этилен и его гомологи Химический элемент кремний
Химический элемент кремний Вугдеводи. Моносахариди
Вугдеводи. Моносахариди Геохимия. Проблемы геохимии. Геохимические методы
Геохимия. Проблемы геохимии. Геохимические методы Алкены – непредельные углеводороды. Получение, химические свойства и применение
Алкены – непредельные углеводороды. Получение, химические свойства и применение Непредельные углеводороды
Непредельные углеводороды Теория сплавов
Теория сплавов Спирты
Спирты